生命理学科が誇る研究グループと所属する教員の研究内容を紹介します。生命理学科は、1942年に創設された生物学教室と、1961年に新設された分子生物学実験施設を母体とする17の研究グループから構成されており、理学部付属臨海実験所、遺伝子実験施設、トランスフォーマティブ生命分子研究所(ITbM)、および創薬科学研究科に属する11の研究グループと連携して、学部/大学院教育と分野横断的な最先端研究を行っています。
研究グループ
※メール送信の際は(at)を@に置換して下さい
生命理学科
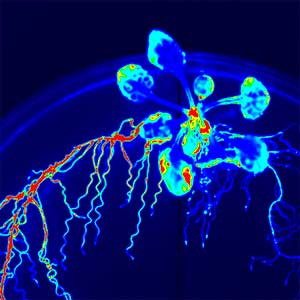
細胞間シグナル研究グループ
新しいホルモンの同定から探る植物の生存戦略
ホルモンとは体内でつくられ、ごく微量で生体のさまざまなはたらきを調節する分子であり、その重要性から動植物を問わず古くから研究者の関心を集めてきました。これまでに、私たちはゲノム情報と生化学的解析を融合させた手法で、植物の成長や環境適応に関わる5種類の新しいペプチドホルモンやその受容体を発見してきました。また、その過程で、植物には篩管内を移行するペプチドを介した独自の長距離シグナリング機構が存在することも見出しました。さらに研究は、受容体下流の情報伝達経路の解明へと展開しています。それぞれのホルモンの機能や情報伝達経路を詳しく調べることで、動き回ることのない植物ならではの巧みな生存戦略を読み解いていくのが私たちの目標です。
広がるペプチドホルモンの世界
25年以上にわたる研究により、私たちは根の形成に関わるRGFや、根の窒素欠乏を地上部に伝えるCEP、成長とストレス応答の切り替えを細胞レベルで制御するPSYなど、植物の成長や環境応答に関わる5種類の新しい分泌型ペプチドホルモン群を発見してきました(図1)。また、葉から根へ篩管を介して、葉の窒素不足を根に伝えるCEPDL2のような長距離移行性の非分泌型ペプチドが存在することも明らかになりました(図2左)。高校の教科書に載っている植物ホルモンはわずかな数ですが、この25年間で世界中で見つかったペプチドホルモンの数は20種類を超えています。それぞれのペプチドホルモンを詳しく調べると、植物が成長や環境適応の過程で実に巧みにホルモンと受容体を介した細胞間シグナリングを行なっていることに驚かされます。
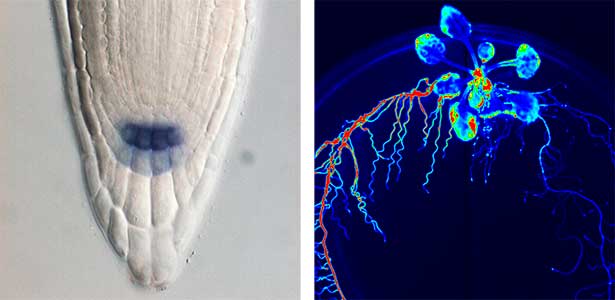
図1.根の形成に必要なペプチドホルモンRGFの発現パターン(左).ペプチドホルモンCEPが関与する全身的窒素要求シグナリング(右).右側の根を窒素欠乏にすると左側の根で硝酸トランスポーターの発現が相補的に上昇する.根から葉へ窒素欠乏を伝えるペプチドホルモンCEPがこの過程に関与している.
翻訳後修飾酵素とタンパク質脱リン酸化酵素
ペプチドホルモンを含む細胞外分泌型のペプチドやタンパク質には、チロシンの硫酸化やプロリンの水酸化、さらにヒドロキシプロリンのアラビノシル化、ガラクトシル化など、様々な翻訳後修飾が観察されます。いずれも、ペプチドやタンパク質の構造を変化させて、特異的な機能を発揮するために必要な修飾です。私たちは、これらの修飾に関わる酵素を同定することに成功しており、その欠損株の表現型を詳細に観察することで、翻訳後修飾の生理的な意義を調べています(図2右)。また、ペプチドホルモンの受容体下流では、タンパク質脱リン酸化酵素が重要な役割を果たしていることが少なくありません。私たちは、タンパク質脱リン酸化酵素の基質の同定を基軸として、タンパク質脱リン酸化を介した新しいシグナル経路の発見を目指しています。
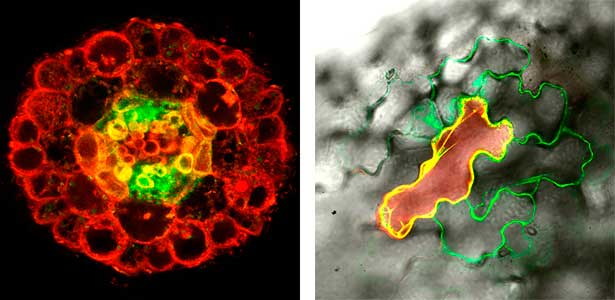
図2.地上部の窒素欠乏を篩管を介して根へ伝えるペプチドCEPDL2(左).根の横断切片において篩管に緑色のシグナルが見える.ヒドロキシプロリンのガラクトシル化の生理機能(右).ガラクトシル化酵素の欠損株では,原形質連絡の透過性が高まり,細胞間の分子移行が促進される.
References
1. Ogawa-Ohnishi M. et al. Science 378, 175 (2022)
2. Ohkubo Y. et al. Nature Plants 7, 310 (2021)
3. Ohkubo Y. et al. Nature Plants 3, 17029 (2017)
4. Nakayama T., Shinohara H. et al. Science 355, 284 (2017)
5. Tabata R. et al. Science 346, 343 (2014)
6. Matsuzaki Y. et al. Science 329, 1065 (2010)
7. Ogawa M. et al. Science 319, 294 (2008)
8. Matsubayashi Y. et al. Science 296, 1470 (2002)
Member
-

教授
松林 嘉克
matsu(at)bio.nagoya-u.ac.jp
ペプチドシグナリングを介した植物の形態形成・環境適応機構
-

助教
大西(小川) 真理
ohnishi(at)bio.nagoya-u.ac.jp
翻訳後修飾酵素を基軸とした細胞間シグナルの機能解析
-

助教
大久保 祐里
ookubo.yuuri.n6(at)f.mail.nagoya-u.ac.jp
タンパク質リン酸化・脱リン酸化を介した植物の環境適応機構
細胞時空間統御グループ
細胞内時空間シグナルの解明
多細胞生物の体は様々な形の細胞で構成されます。植物の体は細胞壁によって形づくられた頑丈な細胞が積み重なるようにして作られています。そのため、個々の細胞の形が植物の組織や器官、さらには個体を形づくる上での基盤となります。植物の細胞壁 はセルロースをはじめとしたさまざまな多糖類で構成されており、細胞壁成分の沈着の仕方が細胞壁の物性、さらには細胞の形態や機能を決定付けます。細胞骨格はこの細胞壁の沈着を導く仕組みの中で中心的な役割を担っています。私たちの研究室では、植物細胞の形づくりの仕組みを理解するために、植物細胞における細胞骨格の構造や動態の制御機構を研究しています。
道管の細胞壁パターンを導く空間シグナル
道管を構成する細胞は、厚く疎水的な細胞壁を沈着した後、プログラム細胞死を起こして中空の構造になります。これにより植物体内で道管液を輸送する丈夫な管となります。この道管の細胞壁は一様ではなく、螺旋や網目等の規則的なパターンに沈着します。私たちの研究室では、独自に開発した道管の細胞培養系を駆使し、このような細胞壁のパターンを誘導する細胞骨格 の挙動と、それを制御する空間的な分子シグナルの実体を明らかにする研究を行っています(図1)。
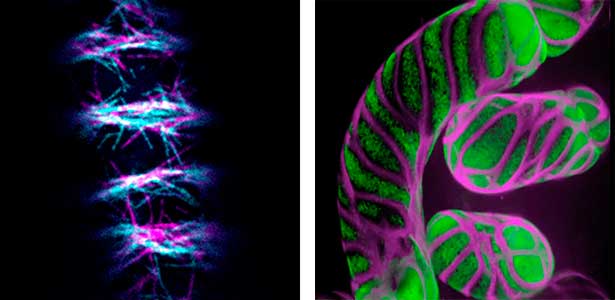
図1.道管要素に分化している培養細胞の微小管(左)と細胞壁(右, 紫).
細胞分裂の制御機構
植物細胞は細胞板を作ることにより細胞質分裂を行います。この細胞板は娘細胞の新たな細胞壁の一部となるため、 細胞板を作る位置や方向は娘細胞の形やその後の運命に大きく影響します。細胞板の形成は、前期前微小管束(PPB)やフラグモプラストといった、植物に固有の細胞骨格構造により制御されています(図2)。私たちはこのような細胞骨格構造が細胞内でつくられる仕組みや、細胞内での位置や方向といった振る舞いが制御される仕組みを研究しています。また、植物がこのような構造や仕組みを進化せてきた道筋の理解にも取り組んでいます。
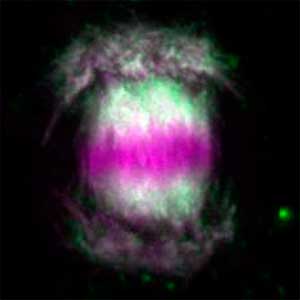
図2.フラグモプラストの微小管(紫)とその制御因子(緑).
References
1. Kijima ST. et al. Nature Commun. 16, 1921 (2025)
2. Higa T. et al. Nature Plants 10, 100 (2024)
3. Sasaki T. et al. Nature Commun. 14, 6987 (2023)
4. Sasaki T. et al. Curr. Biol. 29, 4060 (2019)
5. Sugiyama Y., Nagashima Y. et al. Nature Commun. 10, 468 (2019)
6. Oda Y. and Fukuda H. Science 337, 1333 (2012)
Member
-

教授
小田 祥久
yoshihisa.oda(at)bio.nagoya-u.ac.jp
細胞の形を導く空間シグナルの解明
-

助教
佐々木 武馬
sasaki.takema.w0(at)f.mail.nagoya-u.ac.jp
陸上植物の細胞分裂機構の理解
-

YLC特任助教
杉山 友希
sugiyama.yuki.d8(at)f.mail.nagoya-u.ac.jp
篩要素の自己分解機構の解明
生殖生物学グループ
性と生殖に関する分子機構の解明
性がどうして存在するのか – これは生物学における大きな謎のひとつでありながら、未だ明確な理由は示されていません。当研究室では、ひとつの受精卵からどのようにメスとオスが作られるのか、また身体の性に合わせてどのように幹細胞から配偶子(卵か精子)が作られるのか、その仕組みを分子細胞レベルで解明し、性の意義を理解しようとしています。さらに、自然界に存在する多様な性決定、生殖様式が、進化の過程でどのように生み出されたのかを分子基盤から解明しようとしています。
性決定のコアメカニズム – なぜ性の決まり方は多様なのか
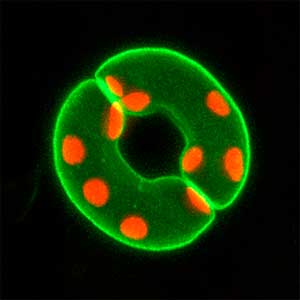
性は遺伝子で決まる生物もいれば、環境によって決まる生物もいます。性決定遺伝子も生物種によって異なります。一方で重要な現象に関わる分子機構は種を超えて共通なのが一般的です。性なくして次世代が作れないほど性は重要であるにもかかわらず、性の決まり方はなぜこのように多様なのでしょうか?我々は、ひとつの性決定方法によらないで性を決める分子基盤(コアメカニズム)に生殖細胞が関係することを明らかにし、この分子機構の解明を行っています。この基盤があるからこそ、性転換などさまざまな性の現象が生じていると考えています(図1)。
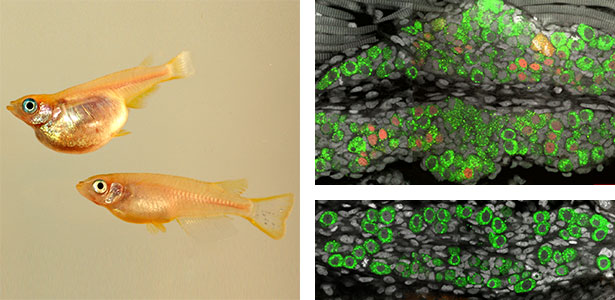
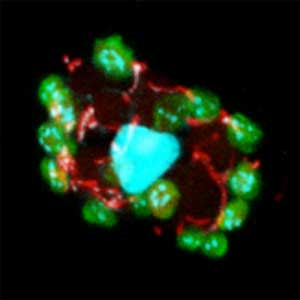
図1.生殖細胞が過多となってオスからメスに性転換したメダカ(左)(上:性転換メダカ,下:通常オス).野生型のメダカ生殖腺(右)(上:卵巣,下:精巣,緑色は生殖細胞).
生殖細胞の性決定 – 幹細胞が卵や精子になるときにはモジュールが動く
卵も精子も同じ生殖幹細胞から分化します。では身体の性に合わせてどのように卵あるいは精子への運命が決まるのでしょうか?我々は生殖幹細胞で働く性決定遺伝子foxl2lを同定しました。さらにこのFOXL2Lは、卵特有の特徴を作り出す複数のモジュールを動かすことを見出しました。減数分裂においても卵特有のモジュールが働いていることがわかり、遺伝子の組換え方、すなわち進化の駆動力が卵と精子では異なる可能性を見出しました(図2)。
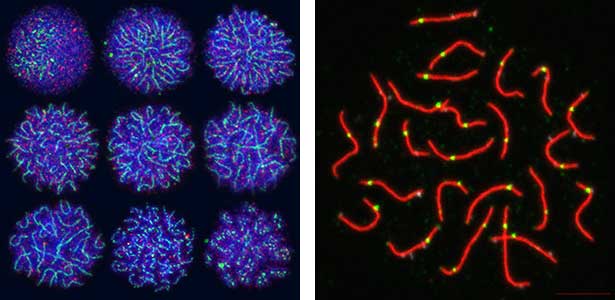
図2.減数分裂のさまざまな段階にある染色体(左)と相同組換え後の染色体(右).緑色の点は交叉箇所.
生殖の多様性をもたらす分子基盤 – なぜ有性生殖から単為生殖が生じたか
自然界には、メスが作る卵のみで次世代を作る雌性発生や、一個体が生涯のうちに性を変える雌雄同体など、さまざまな有性生殖の形態が存在します。このような生殖の多様性はどのようにもたらされるのでしょうか?我々が発見した卵の特徴を作り出す複数のモジュールは、その組み合わせを変えたり、モジュールごとに制御を加えたりすることで、生殖の多様化を説明することができます。研究室では、有性生殖を行うメダカと雌雄異体から派生して雌性発生種になったカダヤシとを用いて、モジュールの変化による生殖の多様化を分子レベルで解明しようとしています。
References
1. Kikuchi M. et al. Development 151, dev201840 (2024)
2. Kikuchi M. et al. PNAS 117, 12174 (2020)
3. Nishimura T. et al. PLoS Genet. 14, e1007259 (2018)
4. Nishimura T. et al. Science 349, 328 (2015)
5. Nakamura S. et al. Science 328, 1561 (2010)
6. Kurokawa H. et al. PNAS 104, 16958 (2007)
7. 田中実「遺伝子から解き明かす性の不思議な世界」一色出版 (2019)
Member
-

教授
田中 実
tanaka.minoru.r3(at)f.mail.nagoya-u.ac.jp
性決定・性分化の分子機構解明
-

助教
菊地 真理子
kikuchi.mariko.g0(at)f.mail.nagoya-u.ac.jp
性と生殖の多様性をもたらす分子機構の解明
-

GSS特任助教
José Carranza Luna
carranza.jose.g9(at)f.mail.nagoya-u.ac.jp
生殖細胞のオス化およびコルチゾルと生殖の分子機構の解明
植物生理学グループ
植物の環境応答機構の解明
動くことのできない植物は、変転する周囲の環境(光、土壌の水分や栄養状態、二酸化炭素(CO2)、温度等)に的確に応答し、成長しなければいけません。植物の表皮に存在する気孔は、様々な環境変化に応答して開閉を行い、光合成に必要なCO2の取込み、蒸散や酸素の放出など植物と大気間のガス交換を調節しています。気孔は、太陽光、特にシグナルとして作用する青色光や光合成を誘導する赤色光に応答して開口し、CO2の取込みを促進し、乾燥ストレスに曝されると、植物ホルモン・アブシジン酸に応答して閉鎖し、植物体からの水分損失を防いでいます。また、気孔はCO2に応答して閉鎖することも知られています。私たちは、このような特質をもつ気孔を環境応答のモデル材料として研究を進め、植物における環境応答のシグナル伝達機構を明らかにしていきたいと考えています。
光シグナル伝達と植物の成長制御
これまでの研究により、植物特有の青色光受容体フォトトロピンが気孔開口の光受容体であり、フォトトロピンに受容された青色光シグナルは、細胞膜H+-ATPaseの活性化を引き起こし、気孔開口の駆動力を形成することを世界に先駆けて明らかにしました(図1)。現在は、気孔開度制御のシグナル伝達機構の全容解明に向け、気孔孔辺細胞を用いた生理・生化学的・遺伝学的な解析や合成生物学的な研究を精力的に進めています。また、トランスフォーマティブ生命分子研究所(ITbM)にも所属することから、ケミカルバイオロジーの視点からの研究も展開しています。さらに、気孔開度の人為的制御によるストレス耐性植物や生産量の向上した農作物の作出も進めています。
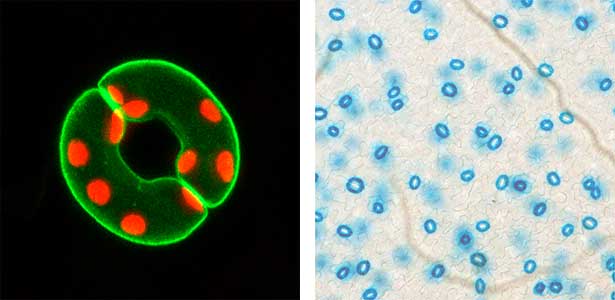
図1.気孔開口のキーエンザイム・細胞膜H+-ATPaseの孔辺細胞における局在(左).緑色がGFP-H+-ATPaseで赤色が葉緑体.気孔特異的プロモーターによるシロイヌナズナの気孔孔辺細胞の染色(右).
植物における水ストレスや二酸化炭素の環境応答機構
陸上植物は、気孔を適切に閉鎖することにより、蒸散による過剰な水分損失を防いでいます。高濃度のCO2に応答した気孔閉鎖は、植物の水利用効率の向上に重要と考えられます。CO2濃度の上昇は、気孔を構成する孔辺細胞内の特異的なセンサー分子により認識され(図2)、気孔閉鎖を導く情報伝達へと変換されます。我々は、生化学や遺伝学、細胞生物学を駆使してこのCO2情報処理装置の機能と分子機構の解明に取り組むとともに、構造生物学やケミカルバイオロジー、質量分析、ゲノム進化などの専門家とも協力しながら、生物の細胞機能の原理を探求しています。
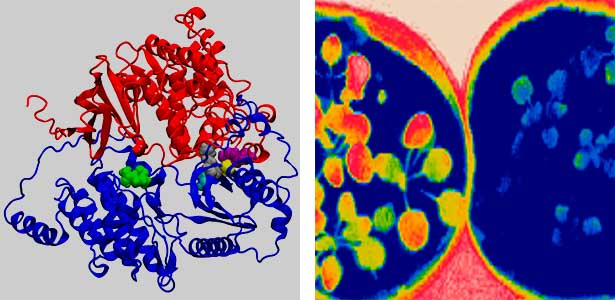
図2.シロイヌナズナのCO2センサーの立体構造モデル(左)とシロイヌナズナ植物体のサーモグラフィー画像(右). CO2非感受性変異体(右ポット)は高CO2濃度環境でも気孔閉鎖せず, 蒸散による葉の温度低下が野生型(左ポット)と比べて著しい.
References
1. Hayashi Y. et al. Nature Commun. 15, 1194 (2024)
2. Aihara Y. et al. Nature Commun. 14, 2665 (2023)
3. Takahashi Y. et al. Science Adv. 8, eabq6161 (2022)
4. Zhang M. et al. Nature Commun. 12, 735 (2021)
5. Kinoshita T. et al. Nature 433, 167 (2005)
6. Kinoshita T. et al. Nature 414, 656 (2001)
Member
-

教授
木下 俊則
kinoshita(at)bio.nagoya-u.ac.jp
植物における環境応答のシグナル伝達機構
-

特任准教授
高橋 洋平
ytakahashi(at)itbm.nagoya-u.ac.jp
植物における水ストレスや二酸化炭素の環境応答機構
-

助教
高橋 宏二
takahashi(at)bio.nagoya-u.ac.jp
植物の細胞伸長制御におけるシグナル伝達機構
-

助教
林 優紀
y-hayashi(at)bio.nagoya-u.ac.jp
気孔孔辺細胞をモデルとした植物の環境応答メカニズムの解析
脳回路構造学グループ
行動を制御する神経機構の解明
配偶行動は、動物界において普遍的にみられる現象です。多くの動物は、配偶相手を選ぶために様々な感覚を駆使してコミュニケーションを行います。私たちは、シンプルな脳を持ち、観察や実験を行いやすい「ショウジョウバエ」と「蚊」を使って、配偶相手とのコミュニケーションを成立させる脳のしくみを調べています。脳内でのどのような神経情報処理によって、特定の感覚刺激から「意味」が抽出されてコミュニケーションが成立するのか、という謎や、それを担う感覚処理がどのように進化に伴って種間分化してきたのか、という謎に、研究室一丸となって取り組んでいます。
聴覚コミュニケーションを担う神経機構
求愛行動の一環として、多くの動物は音を使ったコミュニケーションを行います。ここでは、「求愛歌」と呼ばれる種に固有の音信号を受け手側の動物が評価して、相手を受け入れるかを決定します。では脳は、同種から発せられる特徴的な求愛歌音をどのように認識するのでしょうか。私たちはこの情報処理を担う神経細胞の特性や、神経回路構造を明らかにすることで、その謎に挑んでいます(図1)。ショウジョウバエを使った研究では分子遺伝学を駆使した研究を進めて、音の評価を担う神経機構を理解することを目指しています。さらにその成果を蚊に応用することで、様々な病気を媒介する蚊の繁殖を制御することも目指しています。
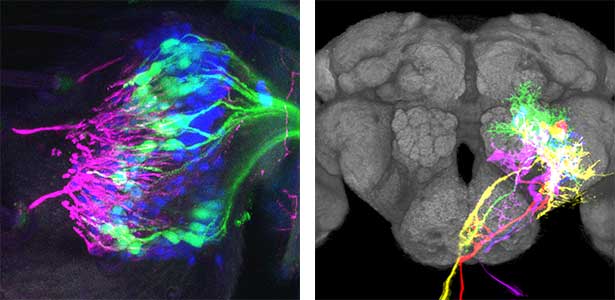
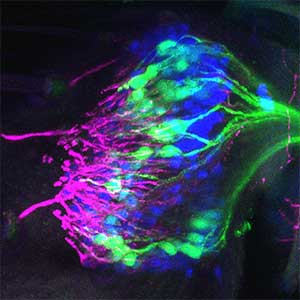
図1.ショウジョウバエの聴覚器の内部(左)と脳の中の神経細胞群(右).
動物の行動進化の神経機構
動物の行動、特にコミュニケーションに使われる信号は種ごとに多様化しています。相手からの信号をうまく受け取り抽出するために、動物の脳はどのように進化してきたのでしょうか?私たちは特に、ショウジョウバエの配偶行動で用いられる音やフェロモンなどの信号が種間で多様化していることに着目し、異なる信号を用いる種の神経細胞や神経回路を比較することで、この謎を解き明かそうとしています。また最近では、花の中で繁殖するショウジョウバエを題材に、昆虫の脳が花からの信号を受け取るためにどのように進化したのかについても調べています(図2)。

図2.ノアサガオの花の中で求愛するカザリショウジョウバエ.
昆虫の本能行動をコントロールする神経機構
昆虫の仲間はシンプルな神経系を持ちながらも、地球上のあらゆる環境に適応して生存し、着実に繁殖を重ねています。着実に繁殖を成功させるために、昆虫が備える本能行動が「どのような形で多様化してきたか?」そして「その背景にはどういった神経機構があるのか?」を知りたいと考えて、ショウジョウバエ科に属する種の求愛・交尾・群れ形成の3つの行動に注目して研究を進めています。本能行動の多様化はショウジョウバエの仲間でも見られます。モデル種であるキイロショウジョウバエを比較対象として遺伝子や神経回路を種間で比べることで、本能行動の進化をもたらす機構を明らかにしたいと考えています。
References
1. Tanaka R. et al. Commun. Biol. 7, 1714 (2024)
2. Imoto K. et al. iScience 27, 110266 (2024)
3. Loh Y.M., Xu Y.Y.J. et al. iScience 27, 110264 (2024)
4. Yamanouchi M.H. et al. iScience 26, 106617 (2023)
5. Ohashi S.T. et al. Sci. Rep. 13, 383 (2023)
Member
-

教授
上川内 あづさ
kamikouchi.azusa.r4(at)f.mail.nagoya-u.ac.jp
聴覚コミュニケーション行動を制御する神経回路機構
-

講師
石川 由希
ishikawa.yuki.e2(at)f.mail.nagoya-u.ac.jp
動物の行動進化の神経基盤
-

講師
田中 良弥
tanaka.ryoya.z3(at)f.mail.nagoya-u.ac.jp
昆虫の本能行動をコントロールする神経機構
-

YLC特任助教
Matthew P. Su
su.matthew.paul.y3(at)f.mail.nagoya-u.ac.jp
蚊の聴覚行動を制御する神経機構の理解
器官機能学グループ
小型魚類を用いた発生生物学と神経科学
脊椎動物において、受精卵から複雑な構造と機能を有する器官が形成する過程は、正確に制御されています。神経組織は背側の外胚葉から誘導されます。神経組織では、前後軸に沿って個々の神経領域が決定され、その領域で神経幹細胞や神経前駆細胞が作られ、さらにニューロンが産生されます。ニューロンは移動しながら神経突起を伸長し神経回路を形成します。また、神経組織の背側には神経堤細胞とよばれる幹細胞が存在し、細胞は移動しながら、色素細胞を含む様々な細胞に分化します。私達の研究室では、ゼブラフィッシュやメダカ等の小型魚類を用いて、ニューロンや色素細胞の分化機構、神経回路の機能の研究を行っています。
神経発生-小脳形成
脊椎動物の小脳および小脳神経回路の構造は、魚類から哺乳類まで比較的保存されています。発生過程において、小脳の主要ニューロンである顆粒細胞とプルキンエ細胞(図1左)は、それぞれ小脳原基の背側と腹側に位置する神経前駆細胞から産生されます。顆粒細胞とプルキンエ細胞は、小脳外から異なる二つの入力線維(苔状線維と登上線維)を受けます。二つの情報はプルキンエ細胞で統合され、最終的に小脳外に出力されます。この単純な図式は、脳の神経回路の形成機構を理解する良いモデルだと考えています。私達は、トランスジェニックゼブラフィッシュを用いて小脳神経回路を可視化し(図1右)、ゲノム編集技術を用いて変異体を作製することによって、小脳ニューロンおよび小脳に入力するニューロンの分化、および小脳神経回路形成の分子機構を明らかにしようとしています。
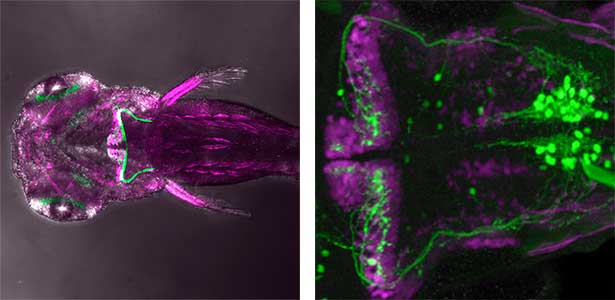
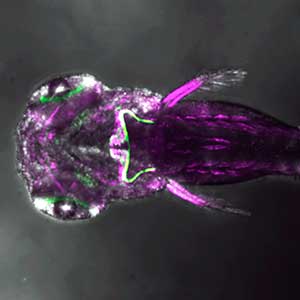
図1.ゼブラフィッシュの小脳の主要ニューロン(左).緑色が小脳顆粒細胞軸索でプルキンエ細胞がマゼンダ色.小脳神経回路の可視化(右).緑色が登上線維でプルキンエ細胞がマゼンダ色.
神経回路機能-恐怖応答学習、社会性行動
小脳は、協調的運動制御や運動学習に関係していると考えられてきました。近年の研究から、小脳は不安・恐怖などの情動や認知といった高次脳機能にも関与していることが知られています。また、小脳神経回路の異常は、自閉症などヒトの精神疾患にも関係していると考えられています。私達は、ゼブラフィッシュを用いて、運動学習、恐怖応答学習、社会性行動における小脳神経回路の役割を解析しています。小脳神経回路の機能イメージングを行い、さらに神経毒素や光遺伝子学ツールを小脳神経回路に発現させ、神経回路の活動を操作することにより、小脳神経回路の高次機能を明らかにしたいと考えています。
神経堤細胞分化-色素細胞分化
色素細胞は、脊椎動物の体色や紋様を作ることに特化した細胞です。哺乳類と鳥類の色素細胞はメラニンを産生するメラノサイト1種類ですが、その他の脊椎動物には、メラノサイトに相同な黒色素胞(黒色を呈する色素細胞)のほかに、虹色素胞と黄色素胞が存在します。また、一部の真骨魚類は、それに加え、白色素胞や青色素胞など多様な色素細胞を持っています。これらの色素細胞は、メラノサイトと同様に、神経堤細胞に由来する共通の色素幹細胞から分化します。つまり、真骨魚類は、哺乳類や鳥類に比べて、より多くの種類の色素細胞を色素幹細胞から分化させていることになります。私達は、魚類、特にメダカ、の色素細胞をモデルとして、変異体を用いて(図2)、幹細胞から多様な細胞種が作られる仕組みを明らかにしようとしています。

図2. 野生型体色のメダカ(上)と黒色素胞および黄色素胞,白色素胞を発生しない変異体メダカ(下).
References
1. Itoh T. et al. Development 151, dev202546 (2024)
2. Hagio H., Koyama W. et al. eLife 12, e83975 (2023)
3. Hagio H., Koyama W. et al. eLife 12, e83974 (2023)
4. Miyadai M. et al. Development 150, dev202114 (2023)
5. Koyama W. et al. eNeuro 8, ENEURO.0507-20.2021 (2021)
Member
-

教授
日比 正彦
hibi.masahiko.s7(at)f.mail.nagoya-u.ac.jp
脳の高次構造形成機構の解明
-

准教授
清水 貴史
shimizu.takashi.k2(at)f.mail.nagoya-u.ac.jp
小脳神経回路の機能解明
-

YLC特任助教
兼子 拓也
kaneko.takuya.n5(at)f.mail.nagoya-u.ac.jp
脳と体を繋ぐ迷走神経ネットワークの形成機構解析

統合進化生態グループ
性的形質・社会行動の進化メカニズム
生物の行動や形態は驚くほど多様で時に奇妙です。こうした生物の姿は、環境や他個体が選択圧となり、生態学的に形作られてきました。しかし、どのような遺伝子や発生・生理的システムの進化が多様性をもたらしたのか、遺伝子と表現型をつなぐ進化のメカニズムはよくわかっていません。統合進化生態グループでは、生態学などのマクロ生物学と、遺伝学・ゲノム科学・発生学などのミクロ生物学を統合することで表現型の進化メカニズムの解明を目指しています。研究室では昆虫・小動物を対象に、行動や形態の生態的意義、表現型を司る遺伝子や生理基盤、表現型可塑性の分子メカニズムについて研究を行っています。遺伝子ノックダウンによる発生操作実験や、組織学、形態学、行動観察、バイオインフォマティクス、野外調査など様々なアプローチを駆使します。
甲虫の武器の進化と可塑性
動物の中には性選択によって華麗な装飾や大きな武器を進化させたものが数多くいます。とりわけ甲虫は、カブトムシに代表されるように大きな角や大顎、闘争用の大きな脚を発達させた種が数多くいます。こうした性選択形質は生存自体には必須ではないため、小さな個体では非常に小さくなり、大きな個体でのみ巨大化する、という共通したパターンがあります。また、多くの種ではオスのみに誇張形質が発達します。我々は、オオツノコクヌストモドキという甲虫を用いて、オスとメスで発生途中に異なる発現をする遺伝子を探索することで、細胞接着に関わる遺伝子が武器の形状に影響を与えていることを見出しました(図1)。また、栄養条件が異なる生育条件では、ヒストン修飾状況が大顎サイズの大小を決めることや、本種の大顎(武器)の栄養応答性がインスリン様ペプチド2(ILP2)によってもたらされることを明らかにしました。

図1.オオツノコクヌストモドキ.オスの大顎はインスリン様ペプチド2(ILP2)のノックダウンによって顕著にサイズが縮小する.左:野生型,右:ILP2のRNAi(遺伝子ノックダウン)により高栄養条件であっても大顎が縮小した個体.
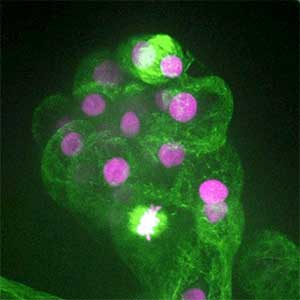
昆虫の社会行動やカースト制の進化
アリなどの社会性昆虫には繁殖に専念する女王、巣内で子育てなどを行う内勤ワーカー、巣外に出て採餌を行う外勤ワーカーなどの様々な“カースト”が見られます。こうしたカーストの差異は、遺伝的に決まっているわけではなく、生育時の栄養条件や他個体との相互作用によって可塑的に決まります。私たちは社会的相互作用、遺伝子発現、生理状態がどのように行動の差異やカースト分化を引き起こしているのかを研究しています。トゲオオハリアリの女王ではインスリン経路の変化などにより代謝活性や繁殖活性が上昇します(図2)。一方、内勤ワーカーは低代謝状態が維持されており、多くのエネルギーを体内に貯蔵する傾向があることがわかってきました。社会的相互作用による生理状態の改変や遺伝子発現の変化に注目し、社会性の進化メカニズムの解明に挑んでいます。
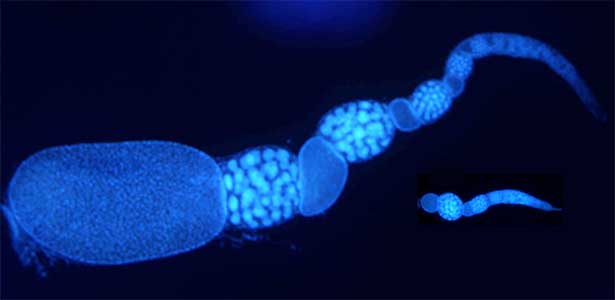
図2.トゲオオハリアリの卵巣.羽化後,順位闘争によって高順位となった個体は卵巣を発達させて女王になり(左),低順位個体は卵巣の発達が抑制され,ワーカーとなる(右).
References
1. Sugiyama M. et al. PLoS Genet. 19, e1011069 (2023)
2. Okada Y. et al. PLoS Biol. 17, e3000541 (2019)
3. Ozawa T. et al. PNAS 113, 15042 (2016)
4. Okada Y. et al. Mol. Ecol. 26, 2922 (2017)
5. Fujioka H. et al. Biol. Lett. 13, 20160743 (2017)
6. Okada Y. et al. J. Insect Physiol. 56, 288 (2010)
Member
-

教授
岡田 泰和
okayasukazu(at)gmail.com
性的形質・社会行動の進化メカニズム

神経行動学グループ
睡眠・記憶の神経基盤
私たちは人生の約1/3を睡眠に費やしています。健康な生活を送るために睡眠は必須ですが、眠っているときに体内で何が起きているのかは明らかになっていません。健康を維持するために必要な”何か”が隠されているのではないかと考えられます。全ての動物が眠ると言われていますので、研究すべき対象は哺乳類に限りません。多くの動物種の睡眠を調べることで、真に重要な要素を絞り込むことができるかもしれません。そこで、私たちは爬虫類など様々な動物の睡眠を詳細に調べることで、睡眠の「意義」および「原則」を明らかにすることを目指します。最先端の電気生理学的手法、薬理学的手法、分子生物学的手法、行動観察など、様々な方法を用いて研究を進めていきます。
睡眠を生み出す脳回路は種を越えて保存されている?
私たちヒトは、一晩の睡眠中にレム睡眠とノンレム睡眠を約90分周期で5回ほど繰り返します。最近、私たちのグループは爬虫類であるオーストラリアドラゴン(以下ドラゴン)もレム睡眠とノンレム睡眠をとることを発見しました(図1)。ドラゴンのレム睡眠とノンレム睡眠の周期はなんと約90秒で、一晩に400回以上も繰り返されます。周期長は動物種ごとに大きく異なりますが、根底に存在する ”レム睡眠・ノンレム睡眠の切替え装置” は種を越えて保存されているのではないかと考えられます。この実体を明らかにすることが私たちの大きな目標の一つです。
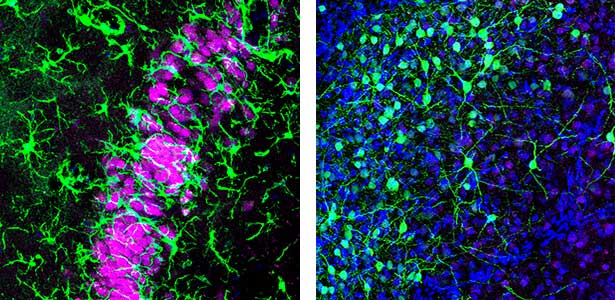
図1.ドラゴンの海馬(左).哺乳類の海馬と酷似した神経細胞の層構造をもつ.マゼンタ:神経細胞,緑:ミクログリア.ドラゴンの前障の神経細胞(右).前障は謎の多い脳領域だが,ノンレム睡眠時の脳波の生成に前障が関与していることを世界で初めて明らかにしている.
睡眠中に記憶が定着する仕組み
私たちが日中に経験した出来事は、夜間の睡眠中に記憶として脳に定着します。近年、海馬で発生するsharp wave ripple(SWR)と呼ばれる脳波が、睡眠中に覚醒時に生じた神経活動を”再生”し、それにより記憶が定着することがわかってきています(図2)。さらに、最近私たちは、SWRが睡眠中に重要な記憶情報を再生する一方で、不要な情報を消去していることを発見しました。これにより、効率的に記憶が脳に刻まれるような仕組みになっていると考えられます。現在は、SWRの更なる役割を明らかにすべく、日夜研究に励んでいます。
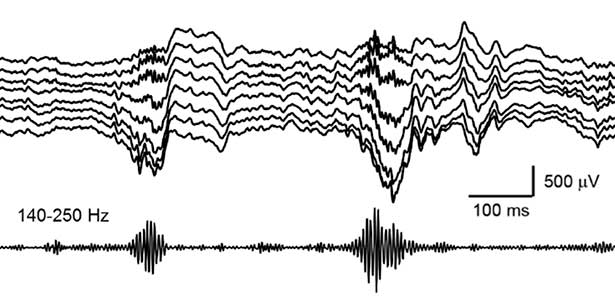
図2.海馬で発生するsharp wave ripple.Rippleと呼ばれる高周波(140-250 Hz)成分が発生する時に記憶の再生が起こる.
References
1. Norimoto H., Fenk L.A. et al. Nature 578, 413 (2020)
2. Norimoto H. et al. Science 359, 1524 (2018)
3. Shein-Idelson M. et al. Science 352, 590 (2016)
Member
-

教授
乘本 裕明
norimoto.hiroaki.h3(at)f.mail.nagoya-u.ac.jp
脳情報の解読と制御
-

助教
向井 康敬
mukai.yasutaka.z3(at)f.mail.nagoya-u.ac.jp
行動を生み出す脳の仕組み
細胞制御学グループ
マウスモデルを用いたヒトの精神・神経病態の探索
アクチン、チューブリン、セプチンは、それぞれ線維状、チューブ状、線維状~リング状に重合するタンパク質です。これら細胞骨格系ポリマーは細胞の形状や剛性を制御し、モータータンパク質と協調して力を発生することにより、細胞の分裂/運動/物質輸送/分化などを遂行します。私たちは、脳・神経系に高発現するセプチンやアダプター分子(CDC42EP4など)に着目して遺伝子改変マウスを作製し、認知機能、運動機能、社会性など、行動レベルの異常から未知の分子メカニズムを探索してきました。特異的な異常をもつ遺伝子改変マウスは、ヒトの疾患(認知症、パーキンソン病、統合失調症、発達障害など)のモデルとして、病態の理解や診断・治療法の開発に有用です。進行中の研究プロジェクトの一部を紹介します。
ヒトの認知機能に関連する遺伝因子と環境因子の相互作用をマウスと培養ニューロンで探索・検証する
ヒトのセプチン遺伝子SEPT3は認知機能に関連するゲノム領域に存在しますが、生理機能は不明です。私たちは、Sept3遺伝子欠損マウスの系統的行動解析によって記憶障害を見出し、その責任領域が海馬歯状回(DG)と呼ばれる部位であることを確定して、DGシナプスの特徴的な形態異常が培養ニューロンでも再現できることを示しました。このマウス/培養系は、ヒトの軽度認知障害(認知症の初発症状である「物忘れ」)のモデルと見なすことができます。興味深いことに、Sept3欠損マウスの記憶障害とシナプス形態異常は、運動量を増やす飼育環境で改善されました。そこで、認知機能の向上効果が知られている環境因子(運動、食餌制限)がもたらす代謝系・内分泌系の変化のうち、どの物質が、どのようなメカニズムでSept3遺伝子欠損による記憶障害/シナプス形態異常を改善しているかを探索しています。
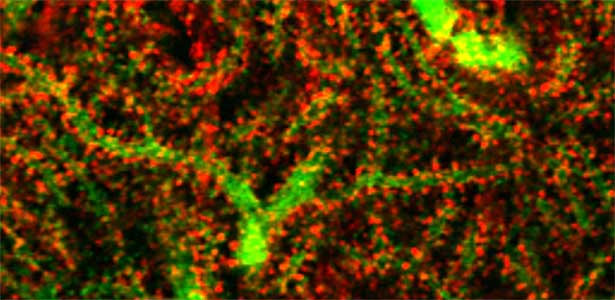
図1.小脳プルキンエ細胞の樹状突起(緑)のシナプスを包囲するグリア細胞突起(赤:CDC42EP4).セプチンとともにグルタミン酸トランスポーターの足場となるこのタンパク質を欠損したマウスでは,神経伝達物質として放出されたグルタミン酸の回収が遅れてシナプス周囲に残留し,運動学習が障害される.
ヒトの知的障害の原因となる遺伝子異常をマウスで再現して分子メカニズムを解析する
脳の発生/発達過程では、Rac/Rho/Cdc42などの低分子量Gタンパク質とエフェクター群が細胞骨格系など多様な下流システムを制御することで、神経前駆細胞の適切な分裂・遊走・分化・突起伸展・シナプス形成などを実現しています。脳の構造異常、知的障害、てんかんなどをもつ小児患者のゲノムには多数の遺伝子変異が見出されますが、病態の原因と確定できたものはごく一部です。そこで私たちは、変異遺伝子をモザイク的に導入したマウス胎仔/新生仔の脳構造や機能の異常を解析することで、多数の遺伝子変異の影響を効率的にスクリーニングし、病態メカニズムを解明することを目指しています。
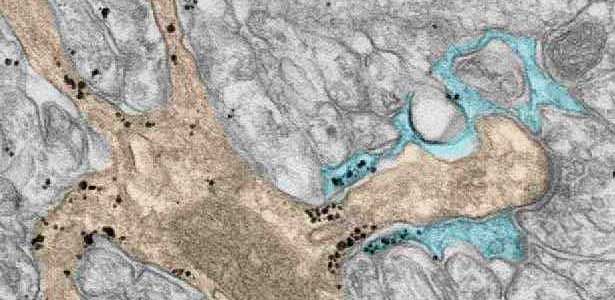
図2.小脳の平行線維(無着色) ― プルキンエ細胞樹状突起スパイン(淡褐色)間シナプスを包囲するグリア細胞突起(青).黒点は細胞膜直下に集積するSEPT5.
References
1. Ageta-Ishihara N. et al. Cell Rep. 6, 115352 (2025)
2. Scala S., Nishikawa M. et al. Brain 145, 3308 (2022)
3. Ageta-Ishihara N. et al. Nature Commun. 6, 10090 (2015)
4. Ageta-Ishihara N. et al. Nature Commun. 4, 2532 (2013)
5. Ihara M. et al. Neuron 53, 519 (2007)
Member
-

教授
木下 専
kinoshita.makoto.u4(at)f.mail.nagoya-u.ac.jp
セプチン細胞骨格系の生理機能とその破綻による障害
-

助教
西川 将司
nishikawa.masashi.z7(at)f.mail.nagoya-u.ac.jp
発達障害と精神・神経疾患の分子病態の解明
-

助教
中嶋 智佳子
nakajima.chikako.g7(at)f.mail.nagoya-u.ac.jp
脳機能の再生を導く分子機構
分子修飾制御学グループ
ユビキチンを通じたタンパク質安定制御システムの解明
私たちの体の中でタンパク質は、必要なときに合成され、その役目を終えると分解されています。従来タンパク質はその合成過程で厳密にコントロールされ、分解過程は細胞内で不要になったものの単なるゴミ処理機構と考えられていました。しかしながら近年の研究により、実はタンパク質分解もさまざまな生体機能を積極的にコントロールする制御系であることが明らかになり、非常に関心を集めています。私たちは、この中でもユビキチン・プロテアソーム系を介したタンパク質分解により制御される生命現象に注目し研究しています。
ユビキチンシステムに制御される生命現象の解明
私たちはユビキチンシステムによる積極的なタンパク質分解が生命現象の多くの場面で重要な働きを担うことを発見してきました。例えば、細胞が入手できる栄養源の量や質が変化すると、物質代謝のスイッチとなるタンパク質が積極的に分解されて細胞内の栄養バランスを保つことを見出しました。細胞に襲いかかる様々な環境ストレスに対して臨機応変に対応するためにもユビキチンシステムによるタンパク質分解が大事であることを明らかにしました。また、細胞が増殖する際にはミトコンドリアなどの細胞内小器官を新しい細胞に分配しますが(図1左)、この過程でもユビキチンシステムが重要な働きをすることを発見しました。この様に、ユビキチンシステムがコントロールする新たな生命現象の発見やその仕組みの解明を行っています。
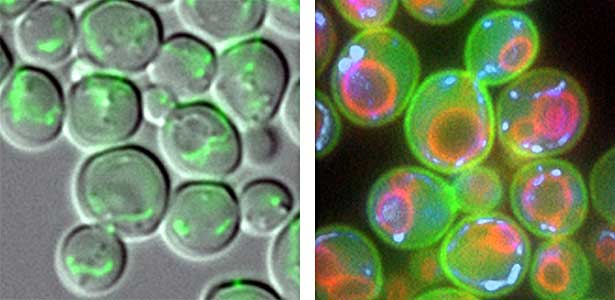
図1.新しい細胞に受け渡されるミトコンドリア(左).酵母細胞の細胞膜(緑),液胞膜(赤),およびミトコンドリアDNA(青)(右).
ユビキチンシステムによる生体膜恒常性維持機構の研究
生命の基本単位である「細胞」は細胞膜に囲まれた閉じた空間です(図1右)。細胞膜が空間を閉じることによって、生命活動に必要な物質が拡散せずに濃縮されます。この働きこそが生命の誕生をもたらしたと言っても過言ではありません。しかし、生体膜にはこの様な「仕切り」としての働きだけではなく、細胞内外での物質や情報のやりとり、生命の維持に欠かせない化学反応の足場、他の細胞との相互作用など多くの働きがあります。その多くの場面で、ユビキチンシステムが重要な仕組みとして関わっています。私たちは、細胞膜などの「生体膜」の成り立ちや多彩な働きについて研究しています。
ユビキチンシステムを通じた人為的タンパク質の分解制御の研究
ユビキチンシステムは細胞内におけるタンパク質の分解機構として、様々なタンパク質の分解を担っています。私たちはこのシステムを利用して、自分たちが壊したいタンパク質を植物ホルモンであるオーキシンという物質を用いて分解するAuxin-Inducible Degron (AID)法を開発しました(図2)。私たちはこのようなタンパク質分解系をより簡単に使えるよう、改良したり、このタンパク質分解系を利用した標的とするタンパク質の機能解析を行っています。
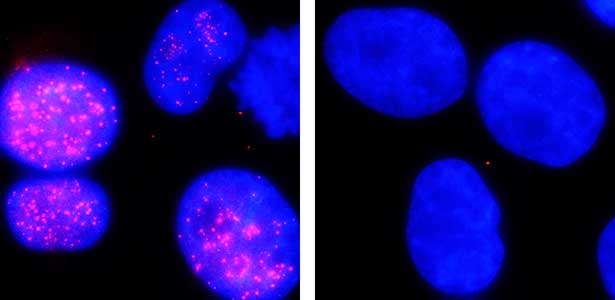
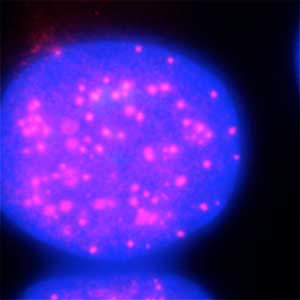
図2.オーキシンによるヒト細胞核内セントロメアタンパク質(赤)の分解.オーキシン処理前(左)とオーキシン処理後(右).
References
1. Obara K. et al. Nature Commun. 13, 2005 (2022)
2. Nishimura K. et al. Nucleic Acids Res. gkaa748 (2020)
3. Nakatsukasa K. et al. Mol. Cell 59, 22 (2015)
4. Kamura T. et al. Science 284, 657 (1999)
Member
-

教授
嘉村 巧
kamura.takumi.k1(at)f.mail.nagoya-u.ac.jp
ユビキチンシステムに制御される生命現象の解明
-

准教授
小原 圭介
obara.keisuke.r2(at)f.mail.nagoya-u.ac.jp
ユビキチンシステムによる生体膜恒常性維持機構の研究
-

講師
西村 浩平
nishimura.kohei.x8(at)f.mail.nagoya-u.ac.jp
ユビキチンシステムを通じた人為的タンパク質の分解制御の研究

分子発現制御学グループ
翻訳領域を決定して遺伝子を理解する
DNAからmRNAが転写され、mRNAからタンパク質が翻訳されますが、mRNAのどこが翻訳されるかを特定することは想像以上に困難です。私たちは最先端技術を駆使し、新たな翻訳領域を多数発見しました。その中には、タンパク質を翻訳しないとされてきたノンコーディングRNAも含まれます。真核生物での1つのmRNAから1つのタンパク質が翻訳されるという定説に反し、複数のタンパク質が産生されることも明らかになりました。遺伝子名はタンパク質機能に基づき付与されますが、複数の異なる機能を持つタンパク質を生み出すとなると、この命名を見直す必要もあります。私たちは、ヒトiPS細胞や遺伝子改変マウスなどを用いて、神経や免疫、がん、老化などの理解を目指しており、新たな疾患治療法の開発へつながる可能性もあります。
精子を形作るための“双子”遺伝子を発見
私たちは、精子に発現するノンコーディングRNAの1つであるGm9999が2種類の小さなタンパク質を産生することを発見し、この2種類のタンパク質を双子座の星の名前にちなんでKastorとPolluksと名付けました(図1左)。KastorとPolluksを欠損した遺伝子改変マウスのオスは不妊になることがわかりました。KastorとPolluksは精子のミトコンドリアに局在していましたが、電子顕微鏡で観察したところ、KastorとPolluksを欠損したマウスの精子はミトコンドリアの形態が異常になっていることがわかりました(図1右)。私たちが同定した小さな双子遺伝子は正常な精子を形作るために必須であり、男性不妊の原因の一つとなっている可能性があります。
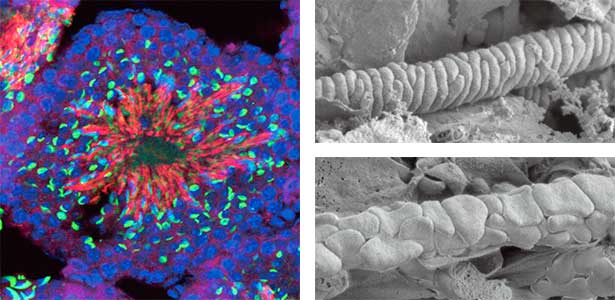
図1.マウス精巣内のPolluksタンパク質の発現(左).青色は全ての細胞の核,緑色は精子の頭部,赤色は精子のミトコンドリアに局在するPolluksタンパク質.精子の走査電子顕微鏡の写真(右).正常精子のミトコンドリア(右上)と,双子遺伝子を欠損した精子のミトコンドリア(右下).
心臓の機能に必須な心筋型リボソームを発見
タンパク質翻訳を実行するリボソームは80種程度のタンパク質から構成されています。私たちは、心臓にはリボソームを構成するタンパク質の1つであるRPL3がRPL3Lに置き換わった心筋型リボソームが存在することを発見しました。心筋型リボソームを欠損したマウスの心臓超音波検査(心エコー)を行ったところ、心臓の収縮力が低下して心不全様の症状を示しました(図2)。拡張型心筋症の患者でRPL3Lの遺伝子変異が報告されていることから、心筋型リボソームの研究はこれら患者の治療につながる可能性が期待されます。
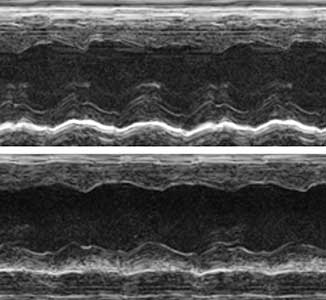
図2.マウスの心臓超音波検査(心エコー).正常の心臓(上)と心筋型リボソームを欠損した心臓(下).
References
1. Shiraishi C. et al. Nature Commun. 14, 2131 (2023)
2. Kito Y. et al. EMBO J. e112869 (2023)
3. Mise S. et al. Nature Commun. 13, 1071 (2022)
4. Nita A. et al. PLoS Genet. 17, e1009686 (2021)
5. Ichihara K. et al. Nucleic Acids Res. 49, 7298 (2021)
6. Matsumoto A. et al. Nature 541, 228 (2017)
Member
-

教授
松本 有樹修
matsumoto.akinobu.i3(at)f.mail.nagoya-u.ac.jp
セントラルドグマの未知の機構の解明
-

助教
市原 知哉
ichihara.kazuya.d5(at)f.mail.nagoya-u.ac.jp
多様な遺伝子発現制御機構の理解
細胞骨格動態の構造的理解
アクチンは、直径5 nm程度の蛋白質で、重合して二本のストランドからなる線維を作り、真核生物の生存に必要不可欠な非常に多くの役割を果たしています。実際、真核生物内において、なんらかの力を発生するプロセスの多く(おそらく半分以上)は、アクチンなしには進みません。ヒトにおいて量の多い骨格筋α、細胞質βアクチンは、トリとヒトでまったく変化していないことからも、その重要性がわかるでしょう。アクチン線維は細胞内で形成と分解を繰り返していて非常に動的であり、この動態がアクチン線維の細胞内の機能に必要不可欠です。私たちは、国内外の多くの研究グループと共同研究しながら、このアクチン線維動態の分子構造レベルの解明を中心に、細胞骨格の構造研究を行っています。
アクチン線維動態の構造的理解
アクチン線維の形成、分解を構造レベルから理解するためには、高分解能構造解析が必要です。細胞内では古くなったアクチン線維が優先的に分解されます。私たちは、クライオ電子顕微鏡法やX線結晶解析を用いてアクチン線維(図1左)がどのように古くなり、分解されやすくなるのかを解明してきました。また、アクチン線維は引っ張られたり回転力が加わったりすると寿命が延びるのですが、その機構も、変異体実験や、実際に引っ張ってみたり回転力を加えたアクチン線維の、電子顕微鏡による線維ゆらぎ解析によってわかってきました。
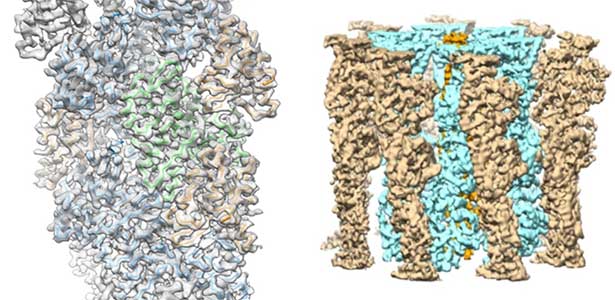
図1.アクチン-コフィリン複合体(左)およびボツリヌス菌ParM線維(右)の構造.
バクテリアと古細菌の細胞骨格
細胞骨格を形成するアクチン線維と微小管は真核生物特有の蛋白質ですが、そのファミリーはバクテリアや古細菌にもあります。私たちは、Robert Robinsonグループと長年バクテリアのアクチンファミリーであるParMについて研究してきました。ParMは、分子構造は互いに良く似ているのですが、線維は非常に多様な構造をとり、蛋白質線維の実験場のようです。2019年にはボツリヌス菌のParMが15本のストランドから成る複雑な構造をとることを解明(図1右)。たった一種類の蛋白質の集合によって、このような構造を作るのは驚きです。また、最近やはりRobinsonグループとの共同研究で、古細菌の微小管の構造解析にも成功しました(図2)。古細菌の微小管は分子単体の構造は真核生物のものに非常によく似ているのに、線維としての構造がまったく異なります。古細菌から真核生物への進化にあたって、この古細菌の微小管がどう進化して真核生物の微小管に変化してきたか、明らかにしていきたいと思っています。
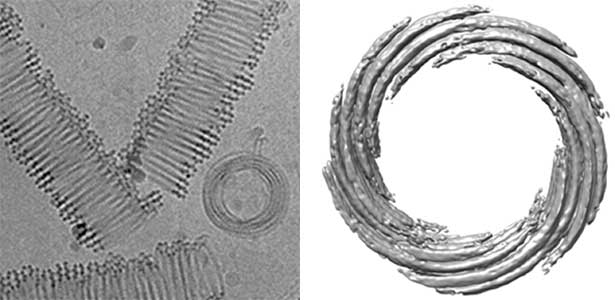
図2.古細菌微小管のクライオ電子顕微鏡写真(左)と三次元構造(右).
References
1. Okura K. et al. J. Mol. Biol. 435, 168295 (2023)
2. Kanematsu Y. et al. PNAS 119, e2122641119 (2022)
3. Akil C. et al. Sci Adv. 8, eabm2225 (2022)
4. Matsuzaki M. et al. Biomolecules 10, 736 (2020)
5. Mizuno H. et al. PNAS 115, E5000 (2018)
6. Tanaka K. et al. Nature Commun. 9, 1860 (2018)
7. Koh F. et al. Nature Commun. 10, 2856 (2019)
Member
-

准教授
成田 哲博
narita.akihiro.x8(at)f.mail.nagoya-u.ac.jp

異分野融合生物学グループ
生命現象の定量的理解へ ー異分野融合生物学研究ー
私たちの究極的な研究目標は、「生命の発生から死に至るまでの現象を定量的に理解すること」。研究の核となっている武器は、数理モデルとコンピュータシミュレーション、AI技術です。さらに、世界中のさまざまな大学、研究所、研究室とネットワークを築き、異なる分野の知見と融合させていくことで、日々最先端の研究を創っています。病原体感染や免疫異常による影響に焦点を当て、遺伝子発現から細胞機能までの時間変化を包括的に分析し、生体内の組織の維持と変化を個人レベルで明らかにしようとしています。iBLabは、国内初の異分野融合研究の拠点として、データサイエンスを駆使した次世代の生命科学研究を切り拓きます。
iBLabの「異分野融合生物学研究」とは?
私たちの研究室では、最先端のモデル駆動型とデータ駆動型のアプローチを組み合わせて使い、異なる分野をつなげることで、これまでできなかった新しい生命科学の研究を進めています。それぞれのアプローチの利点を最大限に生かしつつ、欠点を補う総合的なアプローチを開発することがとても重要になります。たとえば、異なる種類のデータを統合することで、病気の進行や治療の結果を高精度かつ定量的に個人レベルで予測できる研究が行えます。また、現実世界のデータと同じ性質を持つ大量のシミュレーションデータを作成し、さまざまなシナリオを評価することで、デジタル世界で得られた知識を現実に戻すという研究にも取り組んでいます。このように、現実とデジタルの世界を行き来しながら研究を行っています(図1)。
図1.さまざまな分野・領域を融合させた研究.
次世代の感染症研究
近年、COVID-19、エムポックスといった新興・再興感染症が発生し、日本国内への輸入例が相次いでいます。世界各地では、エボラ出血熱、ラッサ熱、クリミアコンゴ熱などのウイルス性出血熱や人獣共通感染症が次々と発生しており、人々の地球規模での移動や都市化、温暖化の影響により、国内においても新興・再興感染症の輸入リスクが高まっています。COVID-19のパンデミックは世界中に大きな影響を与えましたが、同時に人類史上類を見ないほどの質と量のデータが蓄積されました。未だ見ぬ未来のパンデミック感染症と戦うために、私たちのグループは、数理科学技術を駆使して、薬剤・ワクチンの開発、適切な感染症対策、重症化症例の治療戦略の確立を強力にサポートするための異分野融合プラットフォームの構築を目指しています(図2)。

図2.数理モデルやコンピュータシミュレーション,AI技術を用いた感染症研究.
References
1. Hart W.S., Park H., Jeong Y.D. et al. PNAS 120, e2305451120 (2023)
2. Jeong Y.D., Ejima K., Kim K.S. et al. Nature Commun. 13, 4910 (2022)
3. Jeong Y.D., Ejima K., Kim K.S. et al. eLife 10, e69340 (2021)
4. Kim K.S., Ejima K., Iwanami S. et al. PLoS Biol. 19, e3001128 (2021)
5. Iwanami S., Ejima K. et al. PLoS Med. 18, e1003660 (2021)
Member
-

教授
岩見 真吾
iwami.iblab(at)bio.nagoya-u.ac.jp
数理科学技術を駆使した生命科学における異分野融合研究
-

講師
岩波 翔也
iwanami.iblab(at)bio.nagoya-u.ac.jp
生命動態の定量的理解
遺伝学グループ
細胞間相互作用による生体制御機構の解明
多細胞生物を構成する細胞は、地球上の生物個体と同様に、互いに協調したり、その生存を競い合います。そして、そのような細胞同士のコミュニケーションが、組織・器官の形態形成や恒常性維持、さらには、がんの発生・進展においても重要な役割を果たすことが分かってきました。私たちの研究室では、細胞間コミュニケーションに着目した個体レベルでの解析を行う上できわめて優れたモデル系であるショウジョウバエを用い、遺伝学的手法やライブイメージング、数理・物理モデルの構築を通じて、細胞間コミュニケーションを介して (1)発生過程において組織が形作られる仕組み、(2)恒常性が維持される仕組み、(3)がんの発生や進展が引き起こされる仕組みを明らかにしていきたいと考えています。
“細胞競合”の分子機構とその生理機能
細胞同士がその生存を競い合う“細胞競合”現象は、組織や器官のサイズ調節や恒常性維持、がん化に重要な役割を果たすことが分かってきました。私たちの研究室では、細胞同士が「化学シグナル」や「力学シグナル」などを用いてお互いを認識し、“敗者”と“勝者”が決定される仕組みと、また、“勝者”が “敗者”を組織から離脱させるメカニズムを明らかにすること、同時に、その新しい生理機能を明らかにすることを目指しています。
細胞間相互作用を介した上皮変形
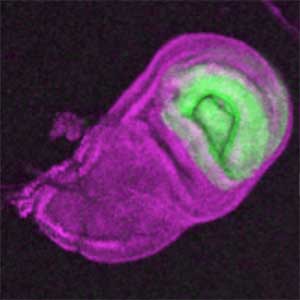
昆虫が示す様々な外部形態(翅や肢、角などの外骨格形態)は、「上皮シートの折り畳み構造」である成虫原基が3次元的に変形することで作られます。私たちの研究室では、実験および数理・物理モデリングを組み合わせ、折り畳んだ上皮を変形する現象の基本法則を明らかにしていきたいと考えています(図1)。
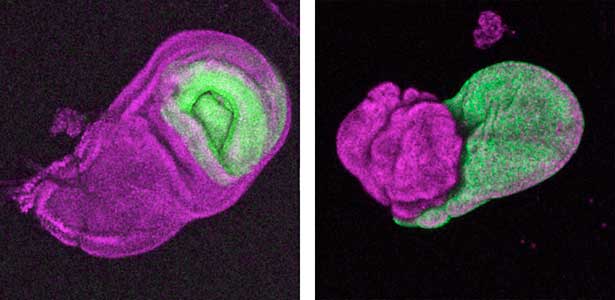
図1.“折り畳まれた”翅成虫原基(左)とその伸展により形成される成虫翅(右).
細胞間相互作用を介したがん発生・進展
近年、がんの発生・進展において、多段階的な突然変異の蓄積による遺伝的変化に加えて、がん原性細胞を取り巻く周囲の細胞との相互作用が重要な役割を果たすことが分かってきました。私たちの研究室では、ショウジョウバエ腫瘍悪性化モデルを用い、がん原性細胞が周囲の正常な上皮細胞や血球系細胞、さらには、遠隔組織との相互作用を介して腫瘍形成・浸潤・転移する仕組みを解析しています(図2)。
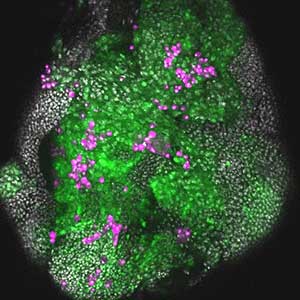
図2.がん細胞群(緑)を誘導した複眼成虫原基.がん細胞群に血球系細胞(マゼンタ)が集積している様子が観察される.
References
1. Akai N. et al. PLoS. Genet. 17, e1009300 (2021)
2. Ohsawa S. et al., Dev. Cell 44, 284 (2018)
3. Yamamoto M. et al. Nature 542, 246 (2017)
4. Ohsawa S. et al. Nature 490, 547 (2012)
5. Ohsawa S. et al. Dev. Cell 20, 315 (2011)
Member
-

教授
大澤 志津江
ohsawa.shizue.x5(at)f.mail.nagoya-u.ac.jp
組織成長/形態形成を制御する仕組みの解明
-

助教
井川 敬介
ikawa.keisuke.w6(at)f.mail.nagoya-u.ac.jp
機械的な力による細胞競合メカニズムの解明
-

助教
八木 克将
yagi.yoshimasa.j2(at)f.mail.nagoya-u.ac.jp
免疫細胞による非自律的細胞増殖制御とその生理機能の解明
-

特任助教(若手新分野創成研究ユニット)
平岡 陽花
hiraoka.haruka.i9(at)f.mail.nagoya-u.ac.jp
細胞競合に基づくがん進展のメカニズム解明と抗がん型核酸医薬の開発
生体機序論グループ
動物のシグナル伝達機構の解明
生物は内外の環境からさまざまな刺激(シグナル)を受け取り、それに応じた適切な応答を行います。このようなシグナルを生命現象に結びつけるしくみをシグナル伝達機構と呼び、生命現象の理解に欠くことのできないものとされています。本研究室では、線虫、魚類および哺乳動物細胞を用いて、切断された神経の再生や神経変性疾患を制御するシグナル伝達機構を研究することで、生体に備わる生命現象の制御メカニズムの解明を行なっています。
神経軸索の再生を制御するシグナル伝達機構
線虫C. elegans は、土壌中で微生物を食べる体長1-2 mmの動物です。ヒトを含む哺乳動物と相同な遺伝子を数多く持ち、しかも遺伝学的・分子生物学的解析が容易なため、 モデル動物として近年脚光を浴びています。当研究室では線虫を用いて、主に神経の再生や加齢変化を制御するシグナル伝達機構について研究を進めています。特に、切断された神経の再生について、 それを制御するシグナル伝達機構の役割を遺伝子レベルから個体レベルまで統合的に理解することで、神経損傷の治療法研究に繋がる新たな礎の構築を目指しています(図1)。
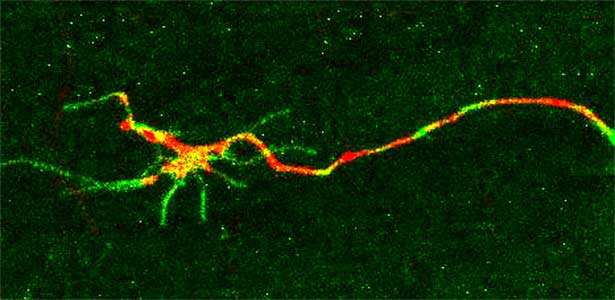
図1.再生中の神経軸索.切断神経を赤色蛍光タンパク質で,コラーゲン受容体DDR-2タンパク質の局在を緑色蛍光タンパク質でそれぞれ可視化した.DDR-2は成長円錐の糸状仮足に多く局在する.
α-シヌクレイン凝集体形成機構とシナプス変性
主要な神経変性疾患であるパーキンソン病では、実際に症状が現れる10〜20年も前(疾患前駆期)から、脳の中でα–シヌクレインの凝集・拡散が起き、それに伴って神経シナプスの機能障害が進行します。私たちは、マウス初代培養神経細胞やグリア細胞を用いたin vitro解析から、疾患前駆期におけるα–シヌクレインの凝集・拡散のメカニズムと、それらが引き起こすシナプスの変性・喪失機構を、分子・細胞レベルで明らかにすべく研究を行なっています(図2)。
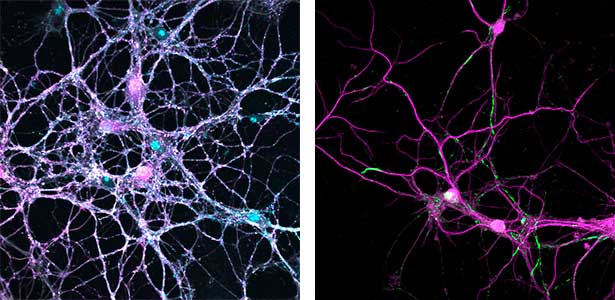
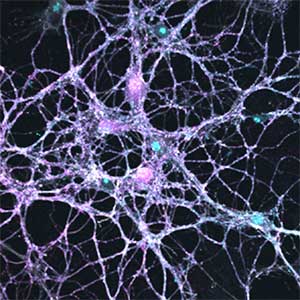
図2.神経細胞―アストロサイト共培養(左)とα-シヌクレイン凝集体(右).マウス海馬由来の初代培養神経細胞に,α-シヌクレイン(緑)のLewy neurite様凝集体(棒状構造体)と,Lewy body様凝集体(球状構造体)が形成された様子(右).
References
1. Sakai Y. et al. EMBO Rep. 23, e55076 (2022)
2. Nakano S. et al. PNAS 117, 1638 (2020)
3. Hisamoto N. et al. Nature Commun. 9, 3099 (2018)
4. Alam T. et al. Nature Commun. 7, 10388 (2016)
5. Hanafusa H. et al. Nature Cell Biol. 17, 1024 (2015)
6. Li C., Hisamoto N. et al. Nature Neurosci. 15, 551 (2012)
Member
-

教授
久本 直毅
i45556a(at)cc.nagoya-u.ac.jp
線虫をモデルとしたシグナル伝達機構の解析
-

准教授
花房 洋
q47371a(at)cc.nagoya-u.ac.jp
哺乳動物細胞を用いたシグナル伝達機構の解析
-

講師
中野 俊詩
z48329a(at)nucc.cc.nagoya-u.ac.jp
線虫をモデルとした神経機能の解析
-

助教
伊藤 翼
itou.tsubasa.j0(at)f.mail.nagoya-u.ac.jp
魚類をモデルとした生体制御機構の解析
発生成長制御学グループ
細胞の形態形成機構の解明
私たちは植物の発生と成長に関与する葉緑体機能の理解をめざして研究をしています。また、精子の長さを決める細胞学的な機構とその進化的な背景に興味をもっています。具体的には、モデル植物であるシロイヌナズナを研究材料とした、植物の形態形成・細胞増殖に関与する葉緑体機能の解明を分子生物学的手法や細胞生物学的手法を用いて研究しています。さらに、コチョウランのゲノム編集基盤技術の開発も行っています。遺伝学の実験によく使われるキイロショウジョウバエは形態学的な特徴があまりない小型で地味な昆虫です。しかし面白いことにその精子が非常に長く、ヒトやマウスの40倍ほどの長さがあり、近縁種には精子の長さが5 cmを超えるショウジョウバエも存在します。このように性別に依存した形質の極端な進化はロナルド・フィッシャーの「暴走進化説」で説明され、私たちはそんな精子の長さを決める細胞学的な機構とその進化的な背景に興味をもっています。
植物の形態形成・細胞増殖に関与する葉緑体機能
葉緑体は光合成をするだけではなく、植物ホルモンやアミノ酸、脂質の合成など植物の生存に必須の物質を合成しています。さらに、核ゲノム遺伝子の発現制御や植物の形態形成や細胞増殖にも関与しています。私達は機能が損なわれると葉緑体を持たない細胞が生じ、葉の形や植物の成長が異常になる葉緑体局在タンパク質を見出しました(図1)。このタンパク質の機能解析を行うことで植物の形態形成・細胞増殖に関与する葉緑体機能を明らかにしようしています。また、コチョウランのゲノム編集技術の開発に取り組み、新しいコチョウランの育種にも取り組んでいます。
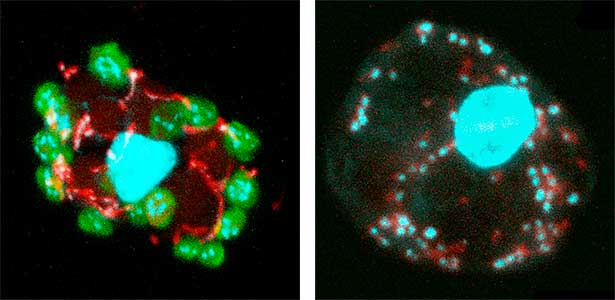
図1.シロイヌナズナ野生型(左)とcrl変異体(右)の葉肉細胞の核,葉緑体(緑),ミトコンドリア(赤),およびDNA(青).
巨大ミトコンドリアの役割
ショウジョウバエの精子のもう1つの特徴はミトコンドリアが巨大化することです。減数分裂直後に少し前まで細胞内で分散していたミトコンドリアが全て凝集し、球状になります(図2)。このミトコンドリが直径約6マイクロメーターあり、一般的な細胞よりも大きく「巨大」と言えるミトコンドリアです。時間と共にミトコンドリアの形状は長い形に変化し、細胞を内側から押し伸ばし、キイロショウジョウバエでは長さが1.8 mmにも達します。面白いことに、巨大ミトコンドリの体積と精子の極端な長さの間には強い相関関係があることがわかりました。そのことから、巨大なミトコンドリアのサイズが精子の長さを決めていると解釈することができ、私たちはその因果関係を証明することと、この不思議な現象の進化的な背景を明らかにしようとしています。
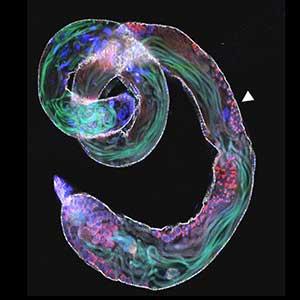
図2.精巣全体を写した写真でも識別できるほどに大きく発達した巨大ミトコンドリア(矢頭).緑色に見えるのが長い精子の束.
References
1. Semiarti E. et al. Indonesian J. Biotech. 25, 61 (2020)
2. Hudik E. et al. Plant Physiol. 166, 152 (2014)
3. Wang S.W. T. et al. Plant Cell Environ. 37, 2201 (2014)
4. Liu Z. et al. Dev. Growth Differ. 53, 822 (2011)
5. Sugiyama S. et al. Genetics 178, 927 (2007)
Member
-

准教授
吉岡 泰
yoshioka.yasushi.k4(at)f.mail.nagoya-u.ac.jp
植物の形態形成・細胞増殖に関与するオルガネラ機能の解明
-

講師
杉山 伸
ssugiya(at)bio.nagoya-u.ac.jp
長い精子と巨大ミトコンドリアの関係
細胞内ダイナミクスグループ
植物の細胞内動態を司るモーター分子の理解
硬い細胞壁に囲まれた細胞を持つ植物では、細胞分裂で生じた娘細胞同士の位置関係がそのまま維持されるため、動物で見られるようなダイナミックな細胞集団運動は起こりません。しかしその一方で、植物体内では植物ホルモンや分泌型シグナルペプチドによって個々の細胞が精密に制御されており、複雑な花や葉といった器官を形成します。そのため、細胞の分裂・分化・成長の制御が植物の形作りにおいて極めて重要な意味を持ちます。細胞の分裂や成長の根幹を担うのは細胞骨格やその制御因子です。私たちはこの形作りの基盤となる細胞骨格やその関連因子の制御機構解明を目指して、基部陸上植物ヒメツリガネゴケを用いた細胞生物学的研究を展開しています。
植物細胞分裂
細胞分裂は最もダイナミックな細胞内現象の一つであり、植物は細胞板という高次構造を形成することで細胞を二分するというユニークな分裂を行います。しかし、細胞板がどのように位置づけられ、どのように形成されているのかなど、ユニークであるが故に植物細胞にはまだまだたくさんの謎が残されています。このため、私たちは細胞内エネルギーを動力に置換するモータータンパク質に焦点を当て、細胞板の形成メカニズム解明に挑んでいます。高解像度の生細胞イメージング、生化学、遺伝学的解析などのツールを駆使し、細胞質分裂制御タンパク質の機能を研究しています(図1)。これにより植物細胞内現象の分子レベルでの動態を解き明かし、植物が抱える未解決の謎に迫ります。
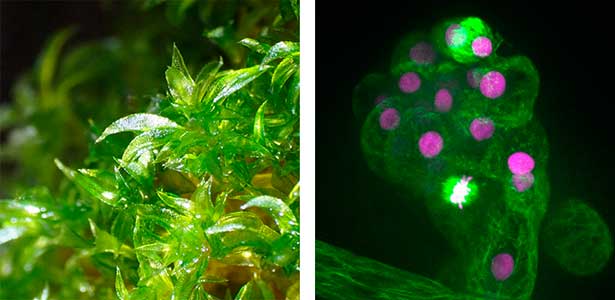
図1.ヒメツリガネゴケの葉(左)と,葉の初期分裂における微小管(緑)およびDNA(マゼンタ)の可視化(右).
References
1. Yamada M. et al. Nature Plants 11, 340 (2025)
2. Leong S.Y. et al. Plant Cell 32, 683 (2020)
3. Wu S.Z. et al. Biophys. Rev. 10, 1683 (2018)
4. Yamada M. and Goshima G. Plant Cell 30, 1496 (2018)
5. Yamada M. et al. J. Cell Biol. 216, 1705 (2017)
Member
-

助教
山田 萌恵
Yamada.moe.d0(at)f.mail.nagoya-u.ac.jp
コケ植物の細胞分裂
私たちは2022年に設立されたばかりの研究グループで、植物細胞を用いた細胞分裂の研究を行っています。私たちの主な研究テーマは、細胞分裂に関与する植物特有の分子や経路を発見することです。私たちの主なモデル生物は、コケ植物Physcomitrium patens (Physcomitrella)です。DNA相同組換え率が高く、ライフサイクルがほぼ一倍体であることから実験生物としては「緑の酵母」の異名を持っています。また基礎研究だけでなく、マイクロ流体デバイスなど、植物細胞生物学の新しい技術の開発にも強い関心を持っています。
Unique features of plant cell division
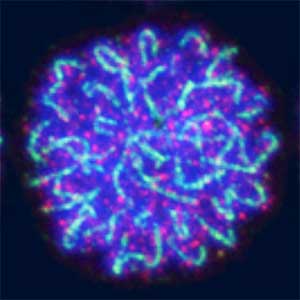
Plant cell division, while sharing the main stages of eukaryotic mitosis, is distinguished from animal mitosis by lack of centrosomes, preprophase band, cytokinesis via phragmoplast. We work to discover unique plant-specific molecules and pathways involved into cell division and potentially harness those towards practical applications. There are several ongoing projects, including CRISPR/Cas9 genetic screening to discover novel cell division genes, investigating relationship between plant kinetochore and polyploidy and mechanisms of spindle positioning in plants (Fig. 1 left).

Fig. 1. Colony of moss Physcomitrium patens (left). Dividing moss cell expressing microtubule (magenta) and kinetochore (green) markers (right).
Microfluidic Device for high resolution cytoskeleton imaging
Microfluidic chip or device is a set of micro-channels molded into a polymer material (PDMS) in which plant cells can be grown without any adverse effects. We can precisely modulate the channel environment by controlling liquid flow in the channels, introducing or wash-out chemical compounds, and observing the cellular response. Furthermore, microdevice offers excellent properties for high-resolution imaging and can be used to visualize protein dynamics at the molecular level. We use microdevices for high-resolution cytoskeleton imaging in the cells of moss P. patens and testing the effect of various chemical compounds on cytoskeleton dynamics (Fig. 1 right).
References
1. Yoshida M.W. and Kozgunova E. Methods Mol. Biol. 2604, 143-158 (2023)
2. Kozgunova E. et al. Nature Commun. 13, 2488 (2022)
3. Kozgunova E. et al. eLife 8, e43652 (2019)
4. Kozgunova E. et al. Sci. Rep. 9, 15182 (2019)
5. Kozgunova E. et al. Plant Cell Physiol. 57, 848 (2016)
Member
-

YLC特任助教
Elena Kozgunova
kozgunova.elena.b1(at)f.mail.nagoya-u.ac.jp
動物細胞間解離機構の研究
血管の壁を開けて出入りすることができるのは白血球と転移性がん細胞ですが、これらの細胞が血管細胞同士のしっかりした結合をどのように解離させるのか、その機構がまだ分かっていません。この機構が分かれば、炎症性疾患やがん転移の薬が作れるかもしれません。私たちは出血性ヘビ毒素による血管解離の機構と共通した機構が存在すると考えて、この謎に挑んでいます。
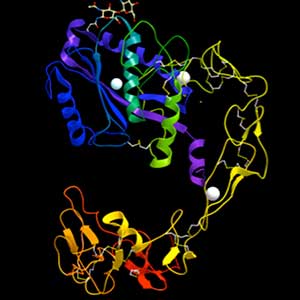
図1.ADAM型出血毒素の構造.
References
1. Seo T. et al. FEBS J. 284, 1657 (2017)
Member
-

講師
荒木 聡彦
araki.satohiko.u0(at)f.mail.nagoya-u.ac.jp
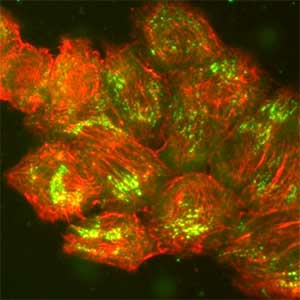
細胞生物学グループ
細胞接着機能の研究
私たちは、主に培養細胞を用いて細胞と細胞外マトリックスがどのように結合しているのかを明らかにする細胞接着機能の研究をおこなっています。多細胞生物は、複数種の細胞が寄り集まって、はじめて一個の生命体として存在できます。このことからも細胞の接着機能は多細胞生物にとって必須の機能であることは明らかです。私たちは、主に上皮組織に存在する接着装置であるヘミデスモソームを研究しています。
上皮組織を基底膜に結びつけているヘミデスモソーム
上皮組織は多細胞生物の体表面や内腔を覆うシート状の体組織で、多細胞生物の体を外部環境に由来する様々なストレスから保護するとともに、体内と体外の間での物質のやり取りを仲介または制限しています。ちょうど単細胞生物の細胞膜に相当する役割を担っていることになります。多細胞生物の体から上皮組織が簡単に剥がれてしまわないためには、上皮シートの直下に存在する基底膜と呼ばれるマトリックス構造に強固に接着される必要があります。ヘミデスモソームは上皮組織を基底膜に結びつけている接着タンパク質複合体です(図1左)。このヘミデスモソームを先天的に形成できない、または機能不全をもたらす後天性の疾患をもつ患者さんでは、皮膚の表皮が基底膜から剥がれてしまうことが知られています。私たちはヘミデスモソームの形成と解体のメカニズムについて、疾患との関わりも含めて明らかにすることを目的に、主に表皮由来の培養細胞を用いて研究を行っています(図1右)。
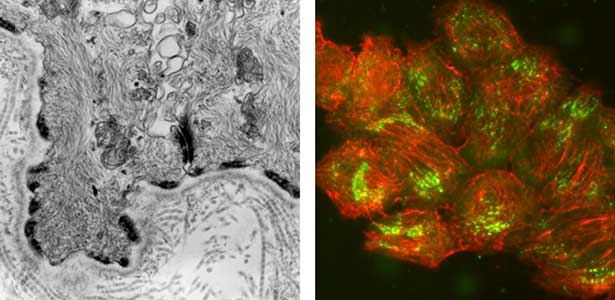
図1.食道上皮基底細胞の電子顕微鏡写真(左).ヘミデスモソームが表皮と真皮の接合部に並んでいる.ラット表皮由来の培養細胞のヘミデスモソームの可視化(右).ヘミデスモソーム(緑)と細胞骨格であるケラチン線維(赤)が見える.
References
1. Maglie R. et al. J. Eur. Acad. Dermatol. Venereol. 37, 249 (2023)
2. Hashimoto T., Hirako Y. and Tsuruta D. Exp. Deramtol. 25, 267 (2016)
3. Yamauchi T. et al. J. Dermatol. Sci. 76, 25 (2014)
4. Hirako Y. et al. Exp. Cell Res. 324, 172 (2014)
Member
-

講師
平子 善章
hirako.yoshiaki.i0(at)f.mail.nagoya-u.ac.jp
細胞膜動態の研究
私たちは、リポソーム(人工膜小胞)を用いた再構成的アプローチによる細胞の形態形成および運動を担う分子機構解明の研究をおこなっています。細胞の形態や運動は、細胞骨格系や分子モーターおよびその他様々な膜制御因子と生体膜が高度に連携することによって担われています。それらを膜の実験モデルであるリポソームに作用させたときの動態を観察解析することで、その機構の分子レベルでの理解を目指します。
生体膜の動態と細胞骨格などの生体因子によるその制御機構
リポソームは生体膜の最も単純化したモデルで、細胞の形態形成や運動の仕組みを再構成アプローチから紐解こうとする研究でよく用いられています。光学顕微鏡を使ったリポソームのリアルタイム観察によって、融合、分裂、穿孔、表裏反転と言ったトポロジー変化を伴うような変形さえ起こす大変動的な性質を生体膜が持っており(図1)、その制御に多様な生体因子が関わっていることが分かってきました。その代表格が、アクチンをはじめとする細胞骨格や分子モーター、あるいは膜作用性のペプチドや蛋白質をはじめとする高分子です。私たちの研究グループでは、細胞の形態や運動を担うと予想される様々な候補因子をリポソームに作用させたときに引き起こされる現象を観察し、その動的機構を解析しています。近年は、アクチン線維によるネマティック液晶形成や液液相分離系内における細胞骨格や核酸、膜の動態の解析と言った、生体因子の天然のソフトマターとしての側面に着目した研究も進めています(図2)。

図1.リポソームのトポロジー変化も伴う劇的な変形例.上から順に,融合,分裂,穿孔,表裏反転.全て暗視野顕微鏡像.
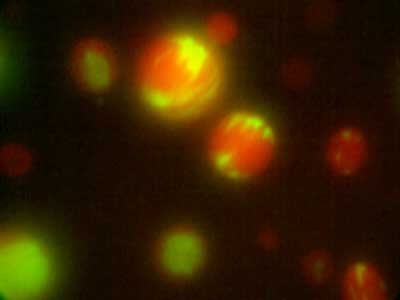
図2.液液相分離を起こしているポリエチレングリコールとデキストランの二成分水溶液にアクチン線維(赤)とDNA(緑)を同時に加えた場合に観察される微小液滴内分布.
References
1. 瀧口金吾 他. 生物物理 63, 5 (2023)
2. Waizumi T. et al. J. Chem. Phys. 155, 075101 (2021)
3. Tanaka S. et al. Commun. Phys. 1, 18 (2018)
4. Tanaka-Takiguchi Y. et al. Langmuir 29, 328 (2013)
Member
-

講師
瀧口 金吾
j46037a(at)nucc.cc.nagoya-u.ac.jp
菅島臨海実験所

海洋生物学グループ
海洋細胞生物学研究-海藻と酵母を中心に
私たちは2007年以降、名古屋・東山キャンパスで動物、植物、真菌類のモデル細胞種を用いて細胞内ダイナミクス、とりわけ微小管が関わるプロセスの研究を展開してきましたが、2020年からは菅島臨海実験所に拠点を移し、海に生息する非モデル生物の細胞生物学研究を開始しました。これらの生物では、細胞成長や細胞分裂など、基盤的な細胞活動でさえ、モデル細胞とは異なる動態を示すことが多いので、その機構の解明や意義の理解を目指しています。さまざまな技法が確立し実験マテリアルも簡単に手に入れられるモデル生物とは異なり、種同定、ゲノムの解読から実験系の確立まで、自分たちで一からやるのは大変ですが、とても楽しいことでもあります。
海生真菌の生物学
酵母や糸状菌といった真菌はパンやビールの原料としてだけではなく、有用抗生物質の発見や、細胞の基盤制御機構の解明など、広く生物学、医学に貢献をしてきました。細胞の基盤制御機構の研究で用いられたのは出芽酵母 S.cerevisiae、分裂酵母 S. pombe、糸状菌 A. nidulans などの限られた種です。しかし、海には多様な真菌類が生息し、モデル真菌とは全く異なる細胞の成長や分裂を示すことがあることが最近の研究でわかってきました。たとえば、環境に応じて細胞の成長・分裂様式を変える黒色酵母種が菅島近海に生息しています(図1)。私たちはこのような表現型の可塑性の分子基盤や進化を探究するなど、海生真菌類について多面的な研究を展開しています。
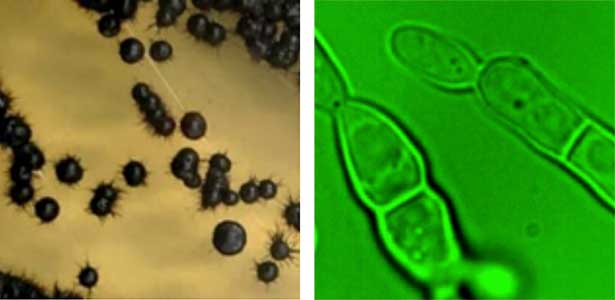
図1.菅島近海で採集された黒色酵母のコロニー(左)と細胞(右).
海藻の細胞生物学
鳥羽は海苔をはじめとして色々な海藻の産地です。私たちは海藻の細胞レベルでの研究を進めています。海には多様な生物種が生息し、その中には細胞レベルで陸上生物とは大きく異なる特徴を有するものも多くいます。たとえば細胞分裂はすべての生物にとって基盤的な活動ですが、このプロセスにおいてですら海藻では「常識外れ」の様式が存在することが示唆されています。これらを理解する上で、陸上生物のモデル細胞種を用いた研究で得られた知見をそのまま当てはめることはできません。現在特に力を入れて研究しているのは緑藻のハネモ(Bryopsis)です。鳥の羽根(フェザー)のような形で10 cm ほどに成長する海藻ですが、驚くことに単細胞生物です。細胞分裂を経ずにどのようにして精巧な形態を形成できるのか、とても興味があります(図2)。

図2.菅島臨海実験所前で採集したハネモ(左)とその拡大(右).
References
1. Yoshida M.W. et al. Nature Plants 9, 733 (2023)
2. Goshima G. Genes Cells 27, 124 (2022)
3. Shirae-Kurabayashi M. et al. PLoS ONE 17, e0264827 (2022)
4. Kim J. and Goshima G. PNAS 119, e2114429119 (2022)
5. Kozgunova E. et al. Nature Commun.13, 2488 (2022)
6. Tsuchiya K. and Goshima G. J. Cell. Biol. 220, e202104114 (2021)
Member
-

教授
五島 剛太
ggoshima(at)gmail.com
海洋生物の多様性・系統進化
海は地球上の約70%を占め多くの生物が暮らしています。海には私達が食べる魚介類や藻類以外にも、様々な生き物が存在し直接的・間接的に私達の生活と関わっています。今後も人類が他生物の恩恵を得て共生していくためには、何という生物が、どこに、どれだけ存在するのか、を把握する必要があります。私達は海産無脊椎動物の系統分類学を中心に、生物多様性・形態や生態の進化を研究しています。生物を採集し、これまで知られている種と形や遺伝子を比較し、未知の種なら新種として記載します。また、「変な」形だったり生態だったりするものはどのように進化してきたのか?を微細構造の観察や水槽での生態把握等を通して明らかにしていきます。
海産無脊椎動物の系統分類学
海産無脊椎動物は生態系において重要な位置を占めていますが、研究が進んでおらず多くの未記載種(新種候補)が存在します。私達は調査船や潜水調査等により北極から南極まで、潮間帯から超深海まで、地球上のあらゆるところで調査し、生物を捕獲・分類します。もちろん採集調査だけでは研究は完結しませんので、きっちりデスクワークする時間も多いですが…。今まで記載された種と比較し、どれとも一致しない時は新種として記載します。過去の文献を元にまだ見ぬ未知の生物を探し冒険するのは、さながらインディージョーンズのような気持ちであり、フィールドワークが好きな人は向いている分野です。
「変な」生き物の形態・生態進化
チョウチンアンコウは何故オスが小さいのでしょうか?クマノミは何故イソギンチャクと共生するのでしょうか?そのような「変な」形だったり生態だったりをしている生物について、進化史を明らかにすることでその「変な」形質のバックグラウンドを探ります。教員自体は共生生態や形態の進化を中心にしていますが、他にも環形動物における高度な眼の進化だったりと「変な」生き物ならばなんでもやります(図1)。

図1.「変な」生き物達の紹介.高性能な眼を獲得したウロコムシ(左).八放サンゴに共生するシリス(右).
生物多様性の創出・維持機構
サンゴ礁には多くの生物が集まり多様性を形成しています。そのような生物多様性を創出する生物を生態系エンジニアと呼びます。近年ゴカイが生態系エンジニアとして働いていることが私達の菅島周辺での潜水調査で明らかになってきました(図2)。この「ゴカイの森」が海洋生態系においてどのような役割を果たしているのか、どのような生物が利用しているか等、研究を進めているところです。

図2.樹上の巣で構成されるゴカイの森.深場の岩礁帯において藻場に代わって多くの生き物を育んでいる.
References
1. Jimi N. et al. Royal Soc. Open Sci. 10, 230039 (2023)
2. Jimi N. et al. Deep-Sea Res. Part I 196, 104025 (2023)
3. Jimi N. et al. Zoosystematics and Evolution 99, 149 (2023)
4. Jimi N. et al. Parasitol. Inter. 90, 1 (2022)
5. Jimi N. et al. J Zool Systema Evol. Res. 59, 801 (2021)
Member
-

講師
自見 直人
beniimo7010(at)gmail.com
遺伝子実験施設
植物分子シグナル学グループ
植物免疫応答のシグナル伝達機構
固着性の生活を営む植物は、脊椎動物が持つような後天性の獲得免疫による疾病防御応答を誘導しません。しかし、植物は病原体の侵入を先天性の受容体で感知する自然免疫と、植物独自の免疫システムにより、高度な生体防御ネットワークを構築しています。私たちは、植物の免疫系を制御するシグナル伝達機構の解明を目指しています。
植物ホルモンが制御する免疫系:全身獲得抵抗性
植物は生体防御システムとして自然免疫を有しており、微生物の細胞壁やべん毛成分などの微生物関連分子パターン、さらには病原体が分泌する毒性物質を細胞膜や細胞内の受容体によって感知すると、多様なシグナル伝達機構を介して免疫システムを活性化します。病原体が感染して自然免疫による疾病防御応答が誘導されると、感染葉から長距離シグナルが分泌され、非感染葉においても免疫システムが活性化されます。これを全身獲得抵抗性(systemic acquired resistance: SAR)と呼びます。SARでは、非感染葉においてサリチル酸(salicylic acid: SA)が蓄積し、SA応答性の遺伝子群が発現します(図1)。私たちは、植物の主要な免疫システムであるSARのシグナル伝達機構を明らかにしたいと考えています。

図1.モデル植物であるシロイヌナズナの野生型植物(左)とNPR1遺伝子を欠損させたnpr1変異体(右).病原性細菌を接種するとnpr1変異体では細菌が増殖し葉が枯死する.
全身獲得抵抗性と環境シグナルのクロストーク
全身獲得抵抗性の成否は、植物の免疫力のみでなく、温度、光、水、虫害など、多様な環境要因に依存することが知られています。それぞれの環境要因と病原体によって活性化する情報伝達系のクロストークを解析することは困難であり、現在も不明な点が多く残されています。私たちは、独自に開発した無細胞タンパク質合成系を用いて、各シグナル伝達機構の制御因子候補を網羅的に合成し、in vitroにおける機能調節機構と生体での役割について調査しています。現在、1)虫害や傷害応答に関与するジャスモン酸シグナル、2)赤色光シグナル、 および3)乾燥応答に関与するアブシシン酸シグナルとのクロストークについて解析しています。
機械刺激が誘導する新奇免疫システム
個々の植物が持つ、微生物を認識する受容体は数百種存在すると推定されますが、自然界に存在する数十万種以上もの潜在的な 病原体を全て認識することは不可能であると考えられます。しかし、植物は大部分の微生物の感染を抑止できることから、私たちは、この認識の問題を克服する新奇免疫システムが存在するのではと仮定しました。最近、私たちは、植物は葉面上の毛状突起であるトライコームが機械刺激(力学的刺激)のセンサーとして機能し、雨などの刺激を感知することで、免疫システムを一過的に活性化することを見出しました(図2)。多くの病原体は、雨滴や風に伝播されて感染するため、植物はこれらの機械刺激を警告シグナルとして捉え、感染に備えているのではないかと考えられます。現在、機械刺激受容体から下流のシグナル伝達機構についての解析を行っています。
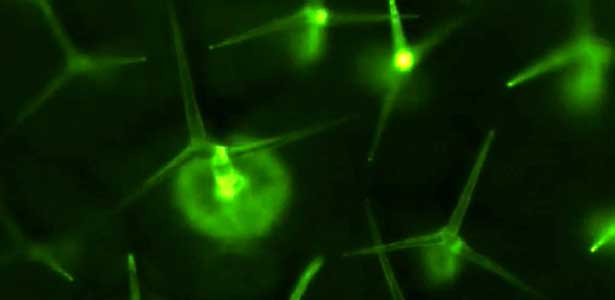
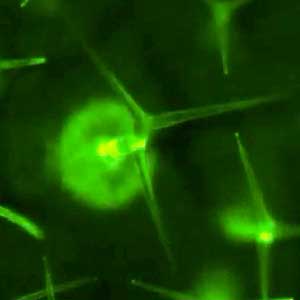
図2.葉面の毛状突起トライコームは機械刺激センサーである.
References
1. Matsumura M., Nomoto M. et al. Nature Commun. 13, 1216 (2022)
2. Nomoto M. et al. Cell Rep. 37, 110125 (2021)
3. Nomoto M. and Tada Y. Genes Cells 23, 46 (2018)
4. Spoel S.H. et al. Cell 137, 860 (2009)
5. Tada Y. et al. Science 321, 952 (2008)
Member
-

教授
多田 安臣
ytada(at)gene.nagoya-u.ac.jp
植物免疫による環境応答調節機構の解明
-

講師
野元 美佳
nomoto(at)gene.nagoya-u.ac.jp
環境シグナルによる植物免疫調節機構の解明
ゲノムから読み解く単細胞微生物の生き様
地球上には肉眼では認識できない微生物が大量に存在していて、様々な環境に適応しています。温度では、0℃から130℃、pHだと0から13、塩濃度だと、真水から飽和塩濃度まで、といった通常環境で生きている私達から見た場合に非常にストレスを受ける環境で生育できるように、それぞれの環境に適応するような選択圧を受けて生き延びてきました。私の研究室では、長い時間かけて進化した結果生じた極限環境への適応多様性について、変異体作成とゲノム解析からアプローチしています。特に、飽和食塩環境に好んで生育する高度好塩性古細菌を材料に用いて、この菌が持つユニークな性質について調べています。
微生物ゲノム解析に必要なツール開発
次世代シーケンスの登場によって比較的簡単にゲノム解析ができるようになり、変異体作成とその原因遺伝子の探索で作業する順方向遺伝学はとても簡単に行えるようになりました。この順方向遺伝子学を効率的に進めるために、96穴のディープ・ウェルを用いた同時並行の培養と96穴のPCRプレートとマグネティックビーズを用いた効率的な核酸精製システムを構築して、大量ゲノム解析を効率的に進める工夫をしています。さらに、1回の解析で300から1000の微生物ゲノムDNAのデータ処理を行うためのデータ解析ワークフローも構築しています。
高度好塩性古細菌
高度好塩性古細菌(以下、好塩菌)は、ほとんど飽和に近い食塩(25%)を含んだ培地に生育している古細菌の一種です(図1左)。ほとんどの好塩菌には、ヒトの視覚に使われているロドプシンに類似したタンパク質が存在しますが、中にはハロロドプシンと呼ばれる塩素イオンポンプだけをもち、pH9~11というアルカリ性環境に好んで生育する菌種も存在します。このハロロドプシンは、塩素イオンが結合していると紫色、塩素イオンがないと青色になりますが、X線結晶構造解析から、その立体構造変化を知ることができました(図1右)。この構造解析を行うために、ハロロドプシンを大量に発現する変異株を使ったのですが、この変異株のゲノム解析から、NP0654Aというタンパク質に突然変異(D324N)が見つかりました。おそらく、NP0654Aの変異が、ハロロドプシン遺伝子発現を著しく上昇させたのだろうと予想しています。変異体を使って微生物が持つ遺伝子の宝探しをしてみませんか?
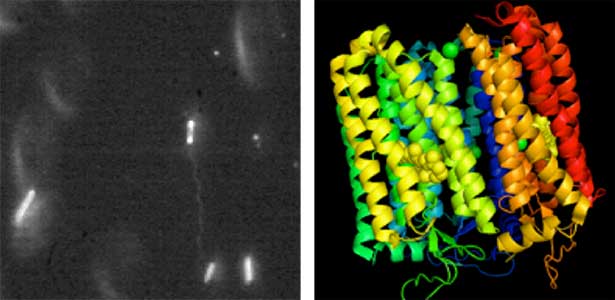
図1.高度好塩性古細菌の暗視野顕微鏡写真(左)とハロロドプシンの立体構造(右).
References
1. Kurauchi T. et al. FEMS Microbiol. Lett. 368, fnab070 (2021)
2. Tomatsu C. et al. FEBS Lett. 592, 1634 (2018)
3. Kouyama T. et al. J.Mol.Biol. 396, 564 (2010)
4. Ihara K. et al. FEBS Lett. 582, 2931 (2008)
Member
-

准教授
井原 邦夫
ihara.kunio.z9(at)f.mail.nagoya-u.ac.jp
多細胞秩序グループ
植物の多細胞秩序の理解
多細胞生物の体の中では、多種多様な細胞群が連絡を取り合い協調して活動しています。その結果、多細胞の集合体である個体の形が巧みに作られたり、環境の変化に個体として柔軟に対応したりします。私たちは、それら細胞群の秩序がいかに作られ維持されるのか、また、その秩序が状況に応じていかに変化するのか、その仕組みの解明を目指しています。とりわけ、芽生えた場所の変わりゆく環境の中で柔軟に生き抜く植物を題材に、細胞間で伝達される様々な情報の分子実体の追求や、その情報伝達のメカニズムの解明、関連する遺伝子群の機能解析、に取り組んでいます。さらに、独自に発見した新作用を持つ人工化合物を活用して多細胞秩序の新たな制御メカニズムを発掘する試みも行っています。
植物体内の美しい多細胞秩序
植物の体は、小さな細胞から大きな細胞まで多くの種類のたくさんの細胞でできています。それらの細胞が幾何学的と表現してもいいような綺麗なパターンで秩序よく配置されています(図1左)。植物の体の中では、細胞が美しく配置されたこのようなパターンがいたる所に存在しています。私たちは、植物体内でそのような秩序だった美しいパターンが作り出される仕組みに興味を持っています。細胞間で伝達される情報の役目を果たす分子(シグナル分子)の役割に着目していますが、とりわけ、体の中の特徴的な部位でのみ生まれるシグナル分子に大きな焦点を当てています(図1右)。
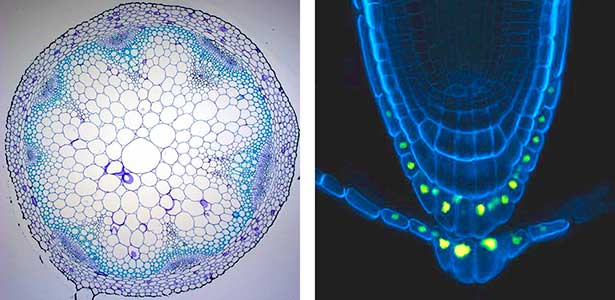
図1.シロイヌナズナの茎の輪切り写真(左).細胞1つ1つの輪郭がわかるように細胞壁を染色してある.根の先端の細胞の輪郭を青く光らせて観察した写真(右).着目したシグナル分子を生みだす細胞の核だけで黄色蛍光タンパク質を光らせてある.
植物の個体秩序を担う情報伝達
植物体内の細胞間でやり取りされる情報の中には、個体丸ごとの生き様を一変させるような情報も存在します。例えば、たった1つの情報の伝達がうまくいかなくなるだけで、個体丸ごとが急速に老化し朽ち果てていく例もあります(図2)。このような、通常ならうまく調節されて整っているはずの「個体丸ごとの秩序(個体秩序)」を支える様々な仕組みに興味を持ち、関わるメカニズムの解明を進めています。特に、個体秩序を支える仕組みの中で作動している情報伝達の仕組みに焦点を当てています。

図2.正常なシロイヌナズナ(左)と、たった1つの情報伝達の異常により個体が急速に老化し朽ち果てていく例(右).
References
1. Murao M. et al. Plant Cell Physiol. 64, 1167 (2023)
2. Negoro S. et al. Plant Cell Environ. 46, 451 (2023)
3. Uchida N. et al. Nature Chem. Biol. 14, 299 (2018)
4. Hirakawa Y. et al. Nature Commun. 8, 14318 (2017)
5. Tameshige T. et al. Curr. Biol. 26, 2478 (2016)
Member
-

教授
打田 直行
uchinao(at)gene.nagoya-u.ac.jp
植物の多細胞秩序の構築・維持・変化の仕組み
-

助教
肥後 あすか
higo.asuka(at)gene.nagoya-u.ac.jp
植物個体の成長を統御するシグナルの解明
トランスフォーマティブ生命分子研究所(ITbM)

植物化学遺伝学グループ
寄生植物のケミカルバイオロジー
寄生植物は、他の植物から栄養を奪って生育する従属栄養の植物です。私たちの研究室では、この奇妙な植物を研究材料に、植物がもつ能力の多様性やその進化を引き起こす分子機構の解明に取り組んでいます。寄生の際には、宿主植物から放出される様々なシグナル分子を感知して次々と形態変化を起こしますが、小分子プローブを使って遺伝子機能の操作や可視化を行うことで、その仕組みが進化の中でどの様に形造られたかを明らかとしていきます。また、アフリカでは、寄生植物の一種であるストライガが穀物生産に大きな被害を与えています。私たちが得た情報をもとに新たな防除法を開発し、食糧増産に貢献することも目指しています。
ストリゴラクトンによる発芽刺激機構
ストライガ(図1)の種子は、宿主植物が近くで生育を始めるまで土の中で発芽せずじっと待っています。宿主が生育を始めると、その根から放出されるストリゴラクトンと呼ばれるシグナル分子を感知して発芽を始めます。私たちは、化学チームと共同で、ストリゴラクトンの受容体タンパク質と反応して蛍光を発するヨシムラクトングリーンという小分子プローブを開発しました。このプローブを使うことで、ストリゴラクトン受容体タンパク質の同定や、ストライガの種子中で波のように起こる受容パターンを観察することに成功しました(図2)。このパターンがどの様につくられ、それがどの様に発芽と結びつくかについての研究を行っています。

図1.トウモロコシに寄生してピンク色の花を咲かせるストライガ.
自殺発芽によるストライガ防除
受容体タンパク質の実態が明らかとなり、その機能を簡単に調べることができるヨシムラクトングリーンという便利なツールが完成したことで、受容体を活性化する人工分子を開発することができる様になりました。人工骨格とストリゴラクトンのハイブリッド分子であるスフィノラクトン-7は、琵琶湖の水量にティースプーン一杯程度混ぜただけでもストライガの発芽を刺激する強力な発芽刺激剤です。この分子を使って、宿主植物がいないところでストライガの種子を強制的に発芽させ、枯死させることに成功しました。現在、スフィノラクトン-7を使った自殺発芽法をケニアの試験圃場で試しています。
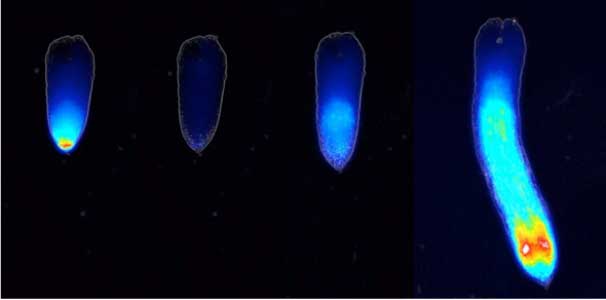
図2.ストライガの種子中で波のように起こるストリゴラクトン受容パターン(左から処理前,4時間後,11時間後.27時間後).
References
1. Uraguchi D. et al. Science 362, 1301 (2018)
2. Tsuchiya Y. et al. Science 350, 203 (2015)
Member
-

特任教授
土屋 雄一朗
yuichiro(at)itbm.nagoya-u.ac.jp
時間制御分子グループ
概日時計の分子機構の解明と制御
概日時計は睡眠・覚醒や代謝など様々な生理機能に見られる一日周期のリズムを支配します。シフトワークや遺伝子変異によって概日時計が乱れると、睡眠障害や代謝疾患、がんなどの病気につながります。そのため、概日時計システムを理解することはヒトの健康増進に大きな意味を持ちます。概日時計は時計遺伝子の転写制御ネットワークによって構成されますが、どのように正確なリズムを生み出すのか、いかに生理機能を調節するのかなど、重要な疑問が残されています。私たちのグループでは生化学とケミカルバイオロジーの融合により、概日時計の分子機構を研究しています。概日時計を調節する化合物の発見は疾患治療薬の開発にもつながるでしょう。
概日時計を調節する化合物の発見
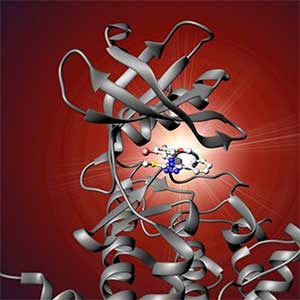
概日時計の分子メカニズムを解明するために、化合物を用いて生物の仕組みを研究するケミカルバイオロジーの手法を応用しています。多様な構造を持つ何万種類もの化合物の中から、ヒト細胞の概日リズムを変化させる複数の化合物を発見しました。これらの新規化合物の機能解析から、概日時計を構成する時計タンパク質のCRY1とCRY2のそれぞれに選択的に作用する化合物を世界で初めて発見しました(図1)。さらに、これらの化合物とCRYタンパク質の複合体の構造を解析することで、選択性を生み出すユニークなメカニズムを解明しました。このように、独自の化合物を用いて概日時計の謎に迫る研究を行っています。

図1.時計タンパク質のCRY1とCRY2のそれぞれに選択的な化合物.
疾患治療への応用に向けた基礎研究
現代社会において、概日時計の乱れとそれに由来する様々な疾患が深刻化しています。概日時計を調節する化合物は、これらの疾患を治療する薬の出発点になると期待できます。CRYに作用する化合物が肝細胞の糖新生を抑制したり、褐色脂肪細胞の分化を促進したり、グリオブラストーマ幹細胞の増殖を抑制することを見出しました。さらに、概日時計に関連するキナーゼのCK2を特異的に阻害する化合物を発見し、急性骨髄性白血病の細胞の増殖を抑制することを見出しました(図2)。これらの化合物がメタボリックシンドロームやがんのモデル動物に与える影響を解析することで、疾患治療に向けた基礎研究にも取り組んでいます。
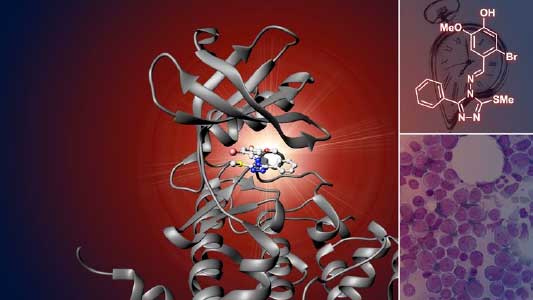
図2.概日時計に関連するキナーゼのCK2を特異的に阻害する化合物.
References
1. Miller S. et al. PNAS 119, e2203936119 (2022)
2. Miller S., Srivastava A. et al. PNAS 118, e2026191118 (2021)
3. Miller S., Son Y.L., Aikawa Y. et al. Nature Chem. Biol. 16, 676 (2020)
4. Oshima T., Niwa Y. et al. Science Adv. 5, eaau9060 (2019)
5. Hirota T. et al. Science 337, 1094 (2012)
Member
-

特任准教授
廣田 毅
thirota(at)itbm.nagoya-u.ac.jp
生体分子動態グループ
イメージングで植物の機能美の秘密を解き明かす
陸上植物は、根を張ったその場所から動けないという性質から、進化の過程で高い環境適応能力を獲得してきました。環境に応じた柔軟な形態形成能力や、土壌からの栄養素吸収を最適化する能力は、植物の環境適応能力を支える重要な要素として知られています。私たちの研究室では、ライブセルイメージング技術を軸に、植物の細胞極性が生まれる仕組みや、栄養素のトランスポーターの動態を制御する仕組み、植物のダイナミックな環境応答メカニズムといった課題に取り組んでいます。私たちはITbMに所属しており、生命理学科だけでなくITbMの化学研究者やドイツ・デュッセルドルフ大学のフロマー・グループとの共同研究を通じて、上記の研究を支える生体分子イメージングツールの開発にも取り組んでいます。
植物細胞の機能美を解き明かす
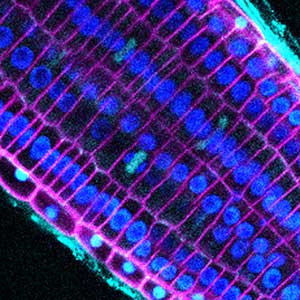
植物の細胞では、栄養素や植物ホルモンを運ぶトランスポーターや、受容体様キナーゼなど、様々なタンパク質が細胞表層で偏ることで、その機能が最適化されています(図1)。このように細胞表層でタンパク質が偏在する現象を一般に細胞極性と呼びますが、植物の細胞極性を制御する仕組みは解明されていません。私たちは、組織の内側と外側に向かって極性局在するホウ酸トランスポーターBOR1や、ホウ酸チャネルNIP5;1などの膜タンパク質をモデルとして、細胞極性を阻害する小分子化合物の単離とその標的探索、生化学的手法による新規極性局在性タンパク質の同定とその機能解析などに取り組んでいます。
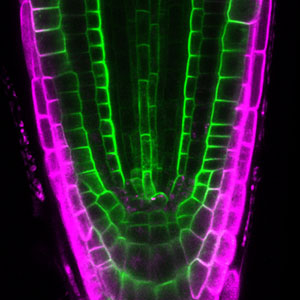
図1.植物の細胞極性.根組織の内側細胞膜に局在するBOR1(緑色)と外側細胞膜に局在するNIP5;1(マゼンタ色).
In vivo biochemistry: タンパク質工学とバイオセンサーの開発
植物の発生過程と環境への応答に関する細胞機能を理解するためには、細胞内の生化学的および生物物理学的プロセスをリアルタイムで定量化し、高解像度の空間情報を取得する必要があります。私たちの研究グループは、蛍光タンパク質を活用し、糖類や植物ホルモンなどの生体分子を定量化するバイオセンサーを開発しています。さらに、ITbMの化学科のグループと共同で、蛍光性低分子を用いたイメージングツールの開発にも取り組んでいます(図2)。また、代謝物のシグナルネットワークを理解するために、代謝物のダイナミクスを精密に制御するための化学合成的アプローチを採用したツールの開発を進めています。

図2.蛍光色素(水色:微小管)と蛍光タンパク質(青:核, 紫:細胞膜)で染め分けられたシロイヌナズナの根.
膜輸送体-基質-阻害剤相互作用
膜輸送体や酵素は、一般的に完全な特異性を持っておらず、多様な化学構造を認識することが知られています。これまでに、SWEET糖輸送体や硝酸イオンおよびペプチド輸送体として知られるNRT/PTRファミリーの輸送体など、特定の輸送体が植物ホルモンの輸送機能を有することが報告されています(図3)。私たちの研究グループでは、ITbMの他のグループとの共同研究を通じて、複数の基質を持つ膜輸送体の基質選択性の分子メカニズムを解明し、各輸送基質の生理的重要性を明らかにすることを目指しています。また、化合物ライブラリーや先端機器を備えた研究センターを駆使して、膜輸送体の阻害剤を同定し、これらを農業研究に応用可能な分子として独自に開発しています。
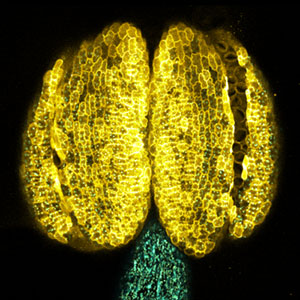
図3.シロイヌナズナ葯におけるショ糖トランスポーター・SWEET13の局在(黄色).SWEET13は花粉の正常な発達に必要である.
References
1. Yoshinari A. et al. Plant Cell Physiol. 65, 1801 (2024)
2. Yoshinari A. et al. Plant J. 118, 1699 (2024)
3. Isoda R. et al. PNAS 119, e2207558119 (2022)
4. Yoshinari A. et al. Plant Cell 33, 420 (2021)
5. Iwatate RJ. et al. Plant Cell 32, 3081 (2020)
Member
-

特任講師
吉成 晃
yoshinari.akira.t2(at)f.mail.nagoya-u.ac.jp

光生物学グループ
光技術で植物の潜在能力を探る
固着生活を営む植物は、雨の日も風の日も、寒い日も暑い日も、芽生えた大地で耐え忍びます。そのため、植物は変動する環境に対して巧妙に応答する機構を進化過程で獲得してきました。私たちのグループでは、光刺激応答、機械的刺激応答(接触刺激応答)など、植物の様々な環境応答現象について、先端イメージング技術を基盤としたライブセル解析を軸に、有機蛍光小分子、マイクロデバイス技術などを駆使して「生きている細胞を観続けること」に重きを置いて研究を展開しています。誰もが思わず驚いてしまう面白い現象の発見とその機構解明を目指しています。
植物細胞の伸長のしくみとその変形能力
植物が障害物に遭遇したときの応答について研究しています。自然界において、植物細胞は自身のサイズよりも小さな空間に遭遇することがあります。例えば、雌しべ柱頭に付着した花粉は次世代に子孫を残すため、花粉管を伸ばし雌組織内の複雑で狭い空間を伸長します。一方、土の中を伸長する根毛は水分や栄養分を吸収するため、土壌粒子の狭い隙間を伸長します。どちらの場合も、花粉管や根毛の通り道は予め用意されていません。それではこれらの細胞は、狭い空間に遭遇した時どうしているのでしょうか。私たちは微細加工技術を用いることにより、花粉管や根毛は細胞を変形させ1ミクロンの隙間を通り抜ける能力があることを発見しました(図1)。植物細胞は、自動車のタイヤの内圧に匹敵する内圧(膨圧)を伸長する力にしています。花粉管や根毛が組織内や土壌中を伸長する時、絶えず細胞壁の剛性と膨圧を上手く制御していると考えられます。私たちは、このように靭やかで力強い植物細胞の潜在能力を発見し、そのしくみを解き明かす研究をしています。
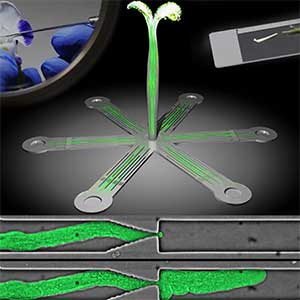
図1.マイクロデバイス内の狭小流路を通り抜ける花粉管.
植物における細胞小器官の配置制御のしくみとその機能発現
植物細胞内の細胞小器官(オルガネラ)、特に葉緑体の分布や数を決めるしくみを解明する研究をしています(図2)。植物のからだを構成する細胞には、その機能を支える細胞小器官が存在し、その数や分布は、適切な「時」に適切な「場」に適切な「数」で分布しています。例えば、暗い岩陰に生息するヒカリゴケは、球形の特殊な細胞内に葉緑体を核の周囲に配置させて青色光と赤色光を吸収し緑色光を反射することが知られています。しかし、その制御機構は全くわかっていません。そこで私たちは、細胞小器官の適材適所・適時適数の制御に関わる細胞骨格関連タンパク質に着目して研究を行っています。

図2.葉緑体の細胞内配置制御.
植物が再生力を発揮するしくみ
植物がもつ驚異的な再生力の謎を解明する研究をしています。植物は、切り株から若芽(ひこばえ)が生え、挿し木によって増殖するように高い再生能力を備えています。このような植物の高い生命力は、特殊な役割をもつ分化細胞が多能性幹細胞になる能力(リプログラミング能力)を発揮しやすい性質に支えられています。植物のリプログラミングには植物ホルモンであるオーキシンやサイトカイニンが深く関与していることが知られていますが、まだわからないことばかりです。私たちは、一細胞解析装置、AIロボット技術、植物ホルモンイメージング技術などを駆使して、植物の再生力を発揮するしくみの解明に取り組んでいます。
References
1. Uno K. et al. Nat. Commun. 12, 2650 (2021)
2. Yanagisawa N. et al. Sci. Rep. 7, 1403 (2017)
3. Sato Y. et al. Sci. Rep. 7, 1909 (2017)
4. Sato Y. et al. J. Biosci. Bioeng. 120, 697 (2015)
5. Wada M. et al. Annu. Rev. Plant Biol. 54, 455 (2003)
Member
-

特任准教授
佐藤 良勝
sato.yoshikatsu.h7(at)f.mail.nagoya-u.ac.jp
植物パターン形成グループ
植物の組織形成の仕組みを分子レベルで紐解く
私たちの生活は気温の変動、乾燥、雨、そしてその他の環境ストレスに晒されています。植物はこれらの変化に対処するための卓越した適応能力を持っています。これは、身動きの取れない植物にとって、必要不可欠な生存戦略です。私たちのグループは、植物が外部の刺激をどのように感知し、その情報を活用して組織形成をするのかを包括的に理解したいと考えています。これにより、植物が環境変化にどのように順応するか、という植物の生存戦略に必要な分子機構の理解に貢献します。また、得られる研究の成果は、植物の生態学、農業、および環境保護分野に重要な示唆をもたらすことが期待できます。
植物の環境ストレスに呼応するシグナル伝達機構の解明
植物は、外部からの情報を感知し、それに対応するための情報伝達物質を作り出します。これは、私たちの神経系が情報を処理するのと似ていて、植物も自己防衛や成長に必要な情報を受け取り、それに応じて器官形成を制御することを示唆します(図1)。私たちは、このシグナル伝達機構の鍵となる因子群の分子機構やそれらの生理作用について研究しています。これらの研究を通して、植物の生存戦略に関する新たな洞察が得られ、将来的には収穫の増加や環境への適応に役立つ知識が得られることが期待できます。
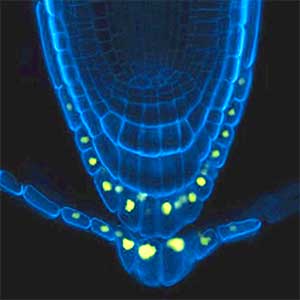
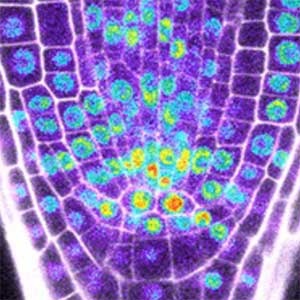
図1.シロイヌナズナの葉表皮組織(左)と根端分裂組織(右).
植物幹細胞の形成・維持に関わる制御機構
植物は根、茎、葉などから構成されています。これらが環境刺激を受けて適切に成長し、機能するために、幹細胞は重要な役割を果たします(図2)。幹細胞は、新しい細胞を生み出す能力を備え、これによって植物は成長し、傷ついた部分を修復することができます。幹細胞が適切に機能するためには厳格な制御が必要です。私たちはこれまでに、植物幹細胞形成の鍵となる因子群の同定に成功していますが、これら遺伝子の調節や相互連携による制御の仕組みについて研究をしています。また、これらの因子がどのような周囲からの刺激を受けて活性化するかについても研究を進めていて、植物の成長と発達を支配する「植物幹細胞」の形成と維持に関わる仕組みを統合的に研究しています。私たちの研究を通じて、将来的には新しい品種の開発や環境への適応力向上につながることが期待できます。
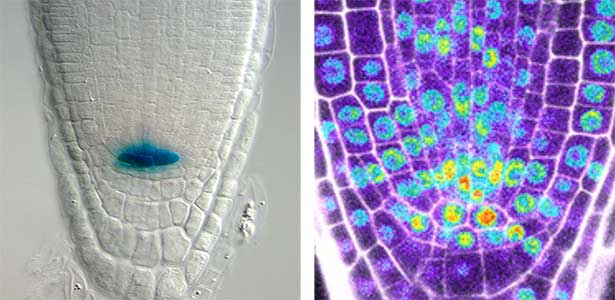
図2.根の幹細胞領域(左)と幹細胞の形成・維持に関わる遺伝子の発現パターン(右).
References
1. Shimotohno A. Plant Biotech. 39, 19 (2022)
2. Shimotohno A. et al. Annu. Rev. Plant Biol., 72, 273 (2021)
3. Shimotohno A. and Scheres B. Curr. Opin. Plant Biol. 51, 74 (2019)
4. Shimotohno A. et al. Genes Dev. 32, 1085 (2018)
Member
-

特任講師
下遠野 明恵
ashimo(at)itbm.nagoya-u.ac.jp
G30国際プログラム
微生物運動グループ
細菌べん毛の回転および本数・形成位置制御機構
私たちが研究対象としている微生物は、人間を含む高等動物に比べてずっと単純な生き物ですが、生きるために必要最小限の仕組みを研ぎ澄まし、太古の昔から巧みに生き残ってきました。高等動物は微生物の持つ基礎的な仕組みを進化の過程で発展させ、高度な生命機能を獲得したのです。つまり生命機能の基本原理は、微生物の生きる仕組みを調べることで解き明かせるのではないでしょうか。私たちの研究室では、たった1つの細胞からなる細菌を材料として、生命の基本現象である「運動」のメカニズムを、運動器官のべん毛を対象として解き明かそうとしています。
細菌の運動器官:べん毛
細胞運動は生命の基本活動であり、運動を担う生体装置の作動原理解明は、生命科学に課された必須課題です。たった一つの細胞からなる原核生物の細菌も、環境中で生き抜くために有害な物質のある環境から逃げ、栄養源の方へ向かって移動する手段として、運動装置を用いています。多くの細菌では運動装置としてべん毛が使われ、螺旋状のべん毛線維部分を根元の細胞表層に埋め込まれたモーターにより回転させ、運動の推進力を生み出しています。
細菌べん毛モーターのエネルギー変換と回転のメカニズム
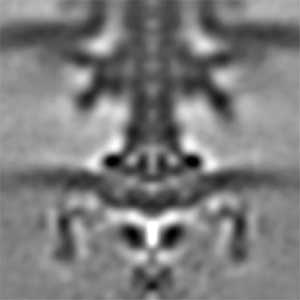
べん毛モーター(図1)は、細胞膜を介したイオンの電気化学勾配(イオン駆動力)から回転力を生み出します。べん毛モーターは生体が持つ唯一の回転運動器官であり、他では例を見ない独自の化学-力学エネルギー変換機構を備えた超分子ナノマシンです。さらにこのモーターは左右両方向に毎秒1000回転もの高速回転ができ、瞬時に方向転換するだけでなく、負荷を感知してエネルギー変換能を調節することができる高性能な分子機械なのです。理学・工学・医学と分野を横断して注目されるべん毛モーターですが、細胞膜を介したイオンのエネルギーがどのように回転力に変換されてモーターが回るのか、その仕組みの多くが謎に包まれています。私たちは、エネルギー変換ユニットである固定子と、回転方向の制御に関わる回転子リングの両方に着目し、構造と機能の関係を解き明かすことでモーターの仕組みを明らかにしようとしています。
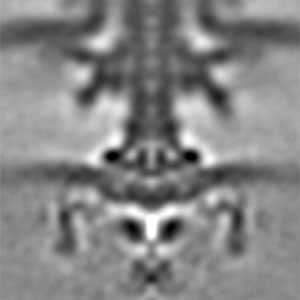
図1.クライオ電子線トモグラフィー法で観察したビブリオ菌べん毛モーター.
べん毛の本数と形成位置の制御
私たちの体は、発生の過程において、機能する分子が適切な時空間制御を受けて働くことで形作られています。また、組織や器官を正常に維持するには、機能分子が各部位に適量配置されて働く必要があり、この仕組みが破綻すると病気になってしまいます。このように生体分子を機能部位へ適切な量で配置することは、あらゆる生物が持つ基本的な機能と言えます。細菌においても、運動器官であるべん毛は、それぞれの菌が棲む環境で適切に運動できるように、本数や形成位置が厳密に決まっています。私たちは細胞の極に1本べん毛を形成する海洋性ビブリオ菌を材料として、なぜ「細胞の極」という特別な位置に、たった1本だけべん毛を形成することができるのか、その仕組みを探ろうとしています(図2)。複雑な生き物を使わずに、単純で増殖の速い細菌を用いて、生体超分子の適量配置機構の解明を目指した研究を進めています。
図2.海洋性ビブリオ菌野生型(左)と多べん毛変異体(右)の電子顕微鏡像.
References
1. Nishikino T. et al. PNAS 122, e2415713122 (2025)
2. Takekawa N. et al. mBio 15, e0126124 (2024)
3. Kojima S. et al. Structure 26, 590 (2018)
4. Ono H. et al. Mol. Microbiol. 98, 130 (2015)
5. Zhu S. et al. PNAS 111, 13523 (2014)
Member
-

教授
小嶋 誠司
z47616a(at)cc.nagoya-u.ac.jp
行動老化の分子神経基盤
我々の神経機能は老化にともなって減弱します。神経機能老化のメカニズムとして、DNAダメージの蓄積や酸化ストレス、アルツハイマー病などの疾患が提唱されています。しかしながら、これらの受動的なメカニズムで種ごとの老化スピードの差異を説明することができるのでしょうか?我々は神経機能老化がゲノムによって積極的に引き起こされているのではないかと考え、線虫C. elegansをモデルとしてそのメカニズムの解明を試みています。
行動老化の分子メカニズム
神経機能の老化を研究する上での大きな障壁は、老化にかかる時間が長いことと、脳が極めて複雑であることです。そこで我々は、寿命が短く単純な神経系を有する線虫C. elegansをモデルとして研究を行っています。線虫は、孵化後3日間で成虫になり、数日の生殖期間を経て、2週間程度で儚い一生を終えます(図1)。その間、302個の限られた神経細胞を使って餌を得るための様々な行動を示しますが、それらの多くは生殖を終えるころに減弱します。我々ヒトでは数十年かけて起こる神経機能の減弱が、線虫においてたった1週間で行動変化としてあらわれる背景には、老化を司る遺伝的プログラムの存在が疑われます。そこで我々は、加齢による行動の減弱が起こらない変異体の順遺伝学的スクリーニングを世界で初めて行い、得られた変異体の解析を行っています。重要な生物学的プロセスの分子メカニズムは線虫から哺乳類まで共通していることが多いので、我々の研究が神経機能老化の根本原理の解明につながることを期待しています。
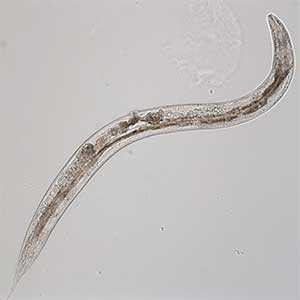
図1.加齢した線虫(成虫10日齢).
行動老化に対する食餌の影響
神経機能の老化には遺伝的プログラムだけでなく、食餌などの環境要因も影響します。我々は線虫の餌である細菌が(図2左)、行動老化に影響を及ぼすことを見出しました。このように食餌や加齢によって起こる行動変化の神経基盤を明らかにするために、我々は神経活動の計測を行っています。神経の活動は細胞内のカルシウム濃度変化として現れます。線虫は体が透明であるため(図2右)、カルシウムの濃度変化に応じて蛍光が変化するタンパク質を用いて、生きたまま神経活動をモニターすることができます。

図2.腸内の細菌(緑)を可視化した線虫(左)および神経細胞の核(赤)を可視化した線虫の頭部(右).
行動老化の生物学的意義
加齢した線虫において減弱する行動は、主に餌に向かうためのものです。もしかすると、老化による神経機能の減弱とそれに伴う行動の変化は、加齢した個体が若い個体と餌を取り合わず、個を犠牲にして集団のメリットを最大化するための仕組みなのかもしれません。線虫は体長が1 mmと小さいので、集団の解析にも力を発揮します。今後は、順遺伝学的スクリーニングによって得られた行動老化が起こりにくい変異体を用いることによって、集団における老化の意義にも迫りたいと考えています。
References
1. Aleogo BM. et al. PNAS 122, e2412391122 (2025)
2. Suryawinata N. et al. Sci Rep. 14, 5529 (2024)
3. Higurashi S. et al. eLife 12, e81418 (2023)
4. Noma K. et al. eLife 6, e26376 (2017)
5. Noma K. and Jin Y. Nature Commun. 6, 8868 (2015)
Member
-

准教授
野間 健太郎
noma.kentaro.f1(at)f.mail.nagoya-u.ac.jp
創薬科学研究科
構造分子薬理学グループ
立体構造を制御し新薬創成に活かす
医薬品は医療の根幹を構成する要素であり、疾病の脅威から私たちの健康・生命のみならず経済活動や文化活動を守る手段です。しかし未だに、根治法がまだ発見されていない疾患や、現在の標準的な治療法が患者さんの大きな負担を伴っている場合など、患者さんの治療満足度が満たされていない疾患が多く存在します。こうした「アンメット・メディカルニーズ」を解消・解決するために、分子の立体構造情報を活用した新しい創薬手法の確立が求められています。私たちの研究室の廣明教授グループではタンパク質の立体構造とNMR情報を活用した新しい医薬品探索手法を、兒玉准教授のグループでは、新規の人工核酸分子を設計・合成し核酸医薬品への実用化を、それぞれ研究しています。
新規抗がん剤候補物質NPL-3009の発見と開発
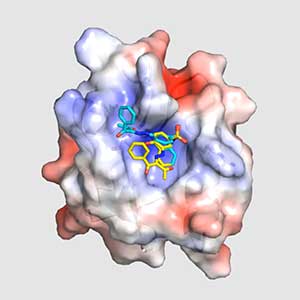
トリプルネガティブ乳がん(TNBC)とは、一般的なホルモン療法や分子標的薬(ハーセプチン)が効きにくいタイプの乳がんで、乳がんの約15~20%を占めます。しかしTNBCでは、Wntシグナル伝達系が亢進しているという報告があることから、私たちはWntシグナルを遮断する可能性のあるDvlの阻害剤を、Dvlの分子構造をヒントに、探索しています。そのうちNPL-3009と名付けた分子と、Dvl-PDZの複合体の構造解明が進行中で、新しい抗がん剤分子の設計・開発に貢献することが期待されます(図1)。

図1.抗がん剤候補物質NPL-3009とDvl1-PDZドメインの複合体構造.
新たな骨格を持つ核酸医薬品候補分子の研究
2023年のノーベル生理学・医学賞は「COVID-19に対する効果的なmRNAワクチンの開発を可能にした核酸修飾に関する発見」を成し遂げたカタリン・カリコ氏とドリュー・ワイスマン氏に授与されました。RNAやDNAを原料(原型)とした分子は生体内で分解されやすく、医薬品としての活性を発揮しにくいことが知られています。私たちは特殊な糖部骨格を持つヌクレオシドを設計・合成し、実際にオリゴ核酸分子に組み込んだ上で、標的のRNAに結合した状態での立体構造解析に挑戦しています。
ヒト赤血球タンパク質が形成する新しい細胞骨格
ストマチン(Band 7.2タンパク質)は、赤血球膜に高濃度に存在する膜タンパク質ですが、赤血球膜の固さなどに関係しているとは言われていたものの、詳しい機能はわかっていませんでした。私たちはストマチンタンパク質の中央部分にあるSPFHドメインの性質を詳しく調べる過程で、このドメインに直線的な線維を形成する能力があることを発見しました(図2)。生理的な条件の変化によって、ストマチンが集合して、赤血球膜の直下で細胞骨格として働いて膜の固さを制御している可能性があります。
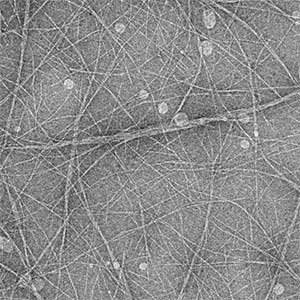
図2.ヒト赤血球タンパク質ストマチンのSPFHドメインが形成する線維の電子顕微鏡像.
References
1. Miura K. et al. J. Virol. 13, e0042623 (2023)
2. Emoto Y. et al. Methods Protoc. 6, 44 (2023)
3. Mizoguchi T. et al. Int. J. Mol. Sci. 24, 4313 (2023)
4. Kataoka K. et al. Curr. Res. Struct. Biol. 4, 158 (2022)
5. Ikeda K. et al. Sci. Rep. 10, 12334 (2020)
6. Moai Y. et al. Nucleosides Nucleotides Nucleic Acids 39, 131 (2020)
Member
-

教授
廣明 秀一
hiroaki.hidekazu.j7(at)f.mail.nagoya-u.ac.jp
タンパク質・薬剤相互作用の観察と構造生物学
-

准教授
兒玉 哲也
kodama(at)ps.nagoya-u.ac.jp
立体構造を制御した新規核酸医薬分子の創成
-

助教
日比野 絵美
hibino.emi.r3(at)f.mail.nagoya-u.ac.jp
タンパク質の凝集機構の研究と凝集阻害薬探索
細胞生理学研究グループ
膜を介した情報伝達機構の解明
チャネル、ポンプ、Gタンパク質共役型受容体などの膜タンパク質は、神経伝達や細胞間連絡、膜を介したイオン輸送を担うことで、様々な生命現象や組織恒常性の維持に関わっています。これらの立体構造と機能を解明することは、生体内の細胞レベルで起こる生命現象の分子基盤の理解に大きく役立ちます。当研究グループでは、クライオ電子顕微鏡を用いた膜タンパク質の高分解能構造解析とそのための技術開発を行い、構造生物学、生化学、細胞生物学、計算機科学を融合して、膜タンパク質が担う生体膜を介した情報伝達分子機構の理解を目指した研究・教育を行っています。
細胞間結合チャネルの構造研究と開閉機構
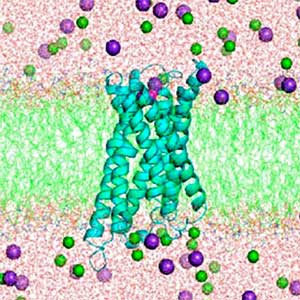
ギャップ結合チャネルは隣接細胞間の細胞質を直接連絡するチャネルとして機能しますが、その開閉機構の構造基盤は未解明です。当研究室ではクライオ電子顕微鏡を用いて、線虫が持つギャップ結合タンパク質イネキシン6の高分解能構造を明らかにしました。可溶化状態と脂質再構成状態の構造の比較から、チャネルの通路に脂質が入り込んで閉塞する開閉モデルを提示しました(図1)。構造解析、機能解析、計算機科学などの複数の手法を組み合わせ、生体膜を介したシグナル伝達機構の解明に取り組んでいます。
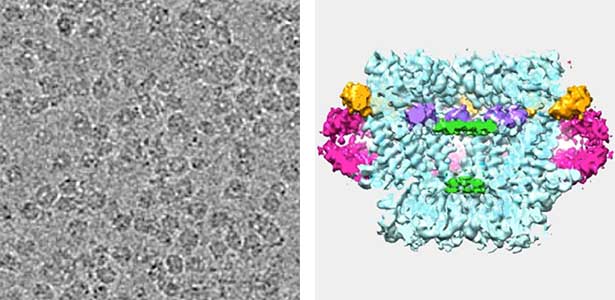
図1.ギャップ結合チャネルのクライオ電子顕微鏡像(左)と三次元再構成(右).
形態形成(パターン形成)におけるチャネルの機能
生物の形づくりには細胞膜に存在するチャネル分子が関わっていることが明らかになってきました。特に、隣接細胞間で低分子化合物やイオンなどを直接的にやり取りするギャップ結合は、動物の体表模様や脊椎骨などにみられる繰り返し構造(パターン)に変化をもたらします(図2)。本研究では、チャネルの持つ電気的性質が、生物の形態形成にどのように関与しているのかにについて解析を進めます。

図2.体表模様に関わるギャップ結合チャネル.
計算機科学を駆使したタンパク質デザイン と新規機能タンパク質の探索
計算機の強力なデータ処理能力を借りることで、自然界には存在していたにもかかわらず、これまで誰も気づかなかった遺伝子の存在に気づき、研究対象にすることができます。一方、計算機に自然現象を上手く模倣させることで、人間が知らないだけでなく、自然界の歴史上でも採択されることがなかった新しい遺伝子を作り出すことができます。これらの2クラスの「未知」を計算機によって探究し、実験によって検証していくことで、人類の知識を少しだけ増やせるような研究を進めます。
References
1. Sakuma K. et al. Protein Sci. 33, e4934 (2024)
2. Suzuki S. et al. Commun. Biol. 5, 707 (2022)
3. Usui Y. and Watanabe M. BBA-Adv. 1, 100006 (2021)
4. Burendei B. et al. Sci. Adv. 6, eaax3157 (2020)
5. Oshima A. et al. Nature Commun. 7, 13681 (2016)
Member
-

教授
大嶋 篤典
atsu(at)cespi.nagoya-u.ac.jp
細胞間連絡を担う膜タンパク質チャネルの開閉機構の解明
-

准教授
渡邉 正勝
watanabe.masakatsu.j2(at)f.mail.nagoya-u.ac.jp
形態形成(パターン形成)におけるチャネルの機能解明
-

助教
佐久間 航也
sakuma.koya.u6(at)f.mail.nagoya-u.ac.jp
計算機科学を駆使したタンパク質デザインと新規機能タンパク質の探索
