|
|
|
| グループ紹介 |
Development and Neurobiology of C.elegans |
|
|
私達は、動物の発生を調べるために、線虫C. elegans を材料に研究を行っています。
セマフォリンという蛋白質を手がかりにして細胞の形態調節のメカニズムに迫りたいと考えています。
また個体内の単一細胞操作のための新技術IR-LEGO を利用して、発生や神経系の機能を単一神経から解明したいと考えています |
|
| |
|
|
|
セマフォリンとは? |
| 私達はセマフォリンという蛋白質を手がかりにして、動物の形作りのなぞに迫りたいと考えています。セマフォリンは、最初、脊椎動物の脳が形作られる際に神経細胞から伸び出した線維の行き先を決める分子(ガイダンス分子)として同定されました。その後、この分子の仲間が広く動物界に存在して大きな分子ファミリーを形成しており、さまざまな組織で形作りのシグナルを伝えることがわかってきました。また、脊椎動物のガンの転移抑制や免疫系の活性化などにも関与することから、最近では医学的な面からも興味を持たれています。私達はセマフォリンの受容体として知られるニューロピリン、プレキシンを世界で最初に発見・クローニングしたという経緯から、これまで一貫してセマフォリンの研究を続けています。 |
|
|
私たちのグループは線虫C. elegans を材料に用いています。C. elegans は特に遺伝学・分子生物学の研究材料としてすぐれており、スピーディーな実験が可能です。発生や老化など生物に共通する基本的現象を研究するために、世界中で用いられています。
特にゲノムプロジェクト、細胞死、RNAi、GPF の応用などの分野でC. elegans の研究が先導的役割を果したことが評価され、これまでに3度ノーベル賞の対象となっています。 |
 |
生物学研究のモデル生物としては大腸菌や酵母も有名ですが、これらの生物にはセマフォリンは存在しません。私達は、セマフォリンシグナル系の基本的な性質を効率良く研究するためには、現在C. elegans が最も有利な実験材料だと考えています。 |
|
|
|
私たちはセマフォリン受容体であるプレキシン遺伝子のC. elegans 変異体を作製し、表皮細胞の形が異常になることを見つけました。そこで、この表皮の異常という表現型を手がかりにしてセマフォリンが細胞内でどのようなシグナルを伝えているのか、そのシグナル伝達経路を調べることにしました。
もし、セマフォリンシグナルと拮抗的に働いたりセマフォリンシグナルを抑制する経路・因子が存在すれば、これらの抑制性経路・因子の変異によってプレキシン遺伝子変異体の異常が改善(suppress)される可能性があります。私たちは、このような変異(サプレッサー変異)の検索を行っています。これまでにサプレッサー変異の原因となる遺伝子を突き止めることで、セマフォリンシグナルがmRNA 翻訳制御に関わるということがわかってきました。細胞形態調節とmRNA 翻訳制御というこれまで無関係と思われていた現象につながりがあることがわかり、私達も大変驚きました(Nukazuka et al., 2008)。面白いことに、最近、脊椎動物でもセマフォリンなどのガイダンス分子がmRNA 翻訳制御を介して神経軸索先端成長円錐の挙動に影響を及ぼすことが報告されています。いろいろな細胞の形態変化において、mRNA 翻訳制御は重要な役割を果たしているのかもしれません。 |
|
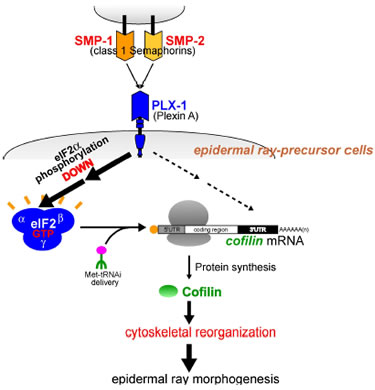 |
図:線虫C. elegan Semaphorin シグナルは表皮細胞の形態・配置を調節し、Plexin 遺伝子(plx-1)の欠損は感覚器ray1 の位置異常を引き起こすことが知られている。このray1 表現型の抑圧変異検索を糸口にして、Semaphorin / Plexin 変異体では翻訳開始因子eIF2aのリン酸化が上昇し、逆にセマフォリンシグナル活性化はeIF2aリン酸化を低下させ蛋白質合成を亢進することが、生体内で証明された。さらに、Semaphorin / Plexin 変異体でのRay 1 位置異常の元となる表皮細胞の形態異常は蛋白質合成低下に起因することが明らかになった。また、セマフォリンは細胞骨格系の調節因子コフィリンの合成を選択的に促進し、この選択性にはコフィリンmRNA 中の3ユUTR が重要であることが明らかになった。これらの結果は、セマフォリンシグナルにより細胞骨格系調節因子が局所的に合成され、その結果、細胞骨格の改変が促進されて細胞形態が変化するという、新規な細胞形態調節機構を示唆している。 |
|
|
| さらに、別のサプレッサー変異rict-1 の研究から、翻訳制御をはじめとする様々な細胞代謝の鍵を握るといわれるmTOR経路とセマフォリンシグナルが密接に関係していることがわかりました。リン酸化酵素であるmTOR は、TORC1 とTORC2 という機能の異なる2 種類の複合体を形成します。私たちはセマフォリンシグナルにはTORC1 を増加させると同時にTORC2 を減少させる働きがあることを発見しました。TORC1 量の増加はmRNA 翻訳の活性化を引き起こし、一方、TORC2 量の減少によりPKCa 活性が抑制されアクチン細胞骨格が変化します(Nukazuka et al., 2011)。セマフォリンシグナルがmTOR 経路を介して細胞形態変化を引き起こすことがわかったことで、セマフォリンシグナルが引き起こす多様な細胞特性の変化を統一的に捉える目処がついてきました。なお、mTOR 経路は現在大変アクティブに研究が進められている経路で、この経路の解明にもプレキシン遺伝子変異体サプレッサー変異検索が役立つと期待しています。 |
|
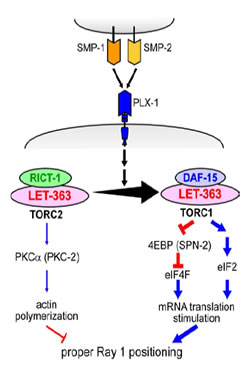 |
図:セマフォリンシグナルは細胞内でTORC1増加とTORC2 の減少を引き起こす。これに伴い、TORC1 下流でeIF2aのリン酸化レベル上昇によるeIF2 系の活性化と、おそらく4EBP のリン酸化を介したeIF4F の活性化とにより、mRNA 翻訳の活性化が引き起こされる。また、TORC2 の下流ではPKCaのリン酸化レベルが減少することによりアクチン重合が抑制されると考えられる。 |
|
|
最近、さらに別のサプレッサー変異の研究から、セマフォリンシグナルによる細胞形態制御にはendocytosis. 膜動態の制御が関与することもわかってきました。まだ詳細は不明ですが、endocytosis は接着因子のような膜蛋白質の動態や細胞膜の面積を調節することで細胞形態変化に関わっているのかもしれません。さて、細胞形態調節というと細胞骨格の再構成が頭に浮かびますがそれだけでなくmRNA 翻訳や膜動態とい
った意外なイベントも重要な役割を果たしていることが、私たちの研究から浮かび上がってきました。おそらく細胞形態変化には細胞のきわめて多面的な特性の変化が必要であり、上記以外の細胞機能も関与するのでしょう。私たちは、セマフォリンシグナルの研究をさらに進めることで、このような生体内での細胞形態変化の実態を明らかにしたいと願っています。 |
|
|
|
|
IR-LEGO:レーザを利用して生体内の単一細胞で遺伝子発現操作 |
形質転換個体中での遺伝子発現操作は生命科学研究で欠かせない技術になっています。しかし、通常の遺伝子組織特異的プロモーターでは、必ずしも実験者の目的の細胞に目的の時期に遺伝子を発現させることはできません。表皮細胞の研究を進める過程で、私たちも、“どうやって均一な細胞集団中の一部の狙った細胞だけで目的の遺伝子を発現させればよいのか”という問題に悩まされました。そして、赤外レーザを利用した遺伝子発現操作用顕微鏡(IR-LEGO: InfraRed Laser Evoked-Gene Operator)を開発中だった弓場俊輔博士(産総研)と共同研究を行い、C. elegans の単一標的細胞での遺伝子発現系を立ち上げました(Kamei et al., 2009)。ほとんど全ての生物は、熱ストレスに対して熱ショック蛋白質を発現して細胞を熱障
害から守ります。そこで、熱ショック蛋白質のプロモーターに解析したい遺伝子Xを繋いだトランスジーン(形質転換体中の外来遺伝子)を作っておけば、細胞を加熱することで目的の遺伝子Xを発現させることができます。このような、トランスジーンを持つ個体を使って顕微鏡下で狙った細胞にレーザ照射をして、その細胞でだけ遺伝子発現を誘導するというのがIR-LEGO の原理です。
IR-LEGO は、“いつでも、どこでも簡単に遺伝子発現を誘導する”ことを可能とする素晴らしい技術です。今後、C. elegans 以外のさまざまな生物種への応用が期待されます。 |
 |
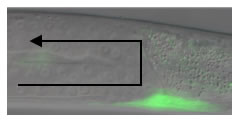
図: IR-LEGO 顕微鏡(左)とGFP を発現させた線虫の神経細胞(右) |
|
| 変異体の単一筋細胞(緑)でunc-6 遺伝子を発現すると、生殖腺は上にも伸びて正しい形になった。 |
unc-6変異体の生殖腺。下に押しつぶされた形( 矢印) をしている |
 |
 |
|
|
図:IR-LEGO を用いた生体内細胞操作の例。C. elegans 幼虫の遠位端細胞(DTC)と呼ばれる細胞は体の中を移動しながら生殖器官を作り上げる。DTC の移動方向は別の細胞で発現する細胞誘導に関わる遺伝子(unc-6)によって制御されており、unc-6 が無い線虫の変異体ではDTCの移動もおかしくなり、正常な生殖器官が形成されない。そこで、変異体の中で、本来unc-6を発現するはずの細胞に赤外線を照射してunc-6 を発現させると、DTC は高い確率で正しい方向に移動できるようになり正常な生殖器官を形成した。IR-LEGO顕微鏡を用いることでunc-6によるDTC の誘導機能をより詳細に調べることができる。 |
|
|
|
最近、さらに別のサプレッサー変異の研究から、セマフォリンシグナルによる細胞形態制御にはendocytosis. 膜動態の制御が関与することもわかってきました。まだ詳細は不明ですが、endocytosis は接着因子のような膜蛋白質の動態や細胞膜の面積を調節することで細胞形態変化に関わっているのかもしれません。さて、細胞形態調節というと細胞骨格の再構成が頭に浮かびますがそれだけでなくmRNA 翻訳や膜動態とい
った意外なイベントも重要な役割を果たしていることが、私たちの研究から浮かび上がってきました。おそらく細胞形態変化には細胞のきわめて多面的な特性の変化が必要であり、上記以外の細胞機能も関与するのでしょう。私たちは、セマフォリンシグナルの研究をさらに進めることで、このような生体内での細胞形態変化の実態を明らかにしたいと願っています。 |
|
|
メダカのトランスポゾンをC. elegans で転位させる |
また、私たちは現在、メダカのトランスポゾンTol1 をC. elegans で転位させる実験系を開発中です(古賀章彦博士: 京都大学との共同研究Kodama et al., 2008))。
C. elegans で現在、一般的に用いられている形質転換法では単一コピーの外来遺伝子を効率良く簡単に染色体に組み込むことが難しく、さまざまな実験の障壁となっています。Tol1 を効率よく生殖細胞で転位させることができれば、形質転換が容易になるだけでなく、C. elegans でこれまでできなかったエンハンサートラップやジーントラップといった実験も可能になります。新しい技術は科学研究の進歩をもたらす原動力の一つです。私たちは、このような技術開発を通じてC. elegans を用いた実験の可能性をさらに広げて生きたいと考えています。 |
|
|
|
|
私達の研究をもっと詳しく知りたいと思った方、私達と一緒に研究してみたいと思った方は、どうぞ気軽に連絡してください。 |
|
高木新(たかぎしん) |
| 名古屋大学理学部生命理学脳機能研究グループ准教授 |
|
〒464-8602
名古屋市千種区不老町理学部地区E館3階327号室 |
|
FAX: 81-52-789-2978 (dial-in)
TEL: 81-52-789-2982 (dial-in)
e-mail: i45116a[at]nucc.cc.nagoya-u.ac.jp |
|
|
|
|
|
|
|
|
|
|
|
原著論文(2000〜) |
| An
optogenetic application of proton pump ArchT to C. elegans
cells. |
Ayako Okazaki, Shin
Takagi
Neurosci Res.75(1):29-34(2013) |
| 文献[Word] |
|
|
| Optical
silencing of C. elegans cells with Arch proton pump |
Ayako Okazaki, Yuki Sudo,
Shin Takagi
PLoS
ONE 7(5):e35370(2012) |
|
|
|
Akira Nukazuka,
Shusaku Tamaki, Kunihiro Matsumoto, Yoichi Oda, Hajime
Fujisawa,
& Shin Takagi
Nature Communications 2:484
doi: 10.1038/ncomms1495 (2011). |
| [以下、この論文の解説記事] |
| Semaphorins
contribute to cellular changes by regulating two TOR complexes |
|
|
|
Yasuhiro Kamei,
Motoshi Suzuki, Ken Watanabe, Kazuhiro Fujimori, Takashi
Kawasaki,
Tomonori Deguchi, Yoshihiro Yoneda, Takeshi Todo, Shin
Takagi, Takashi Funatsu, &
Shunsuke Yuba
Nature Methods.
6(1), 79-81 (2009).
[selected paper: Faculty of 1000, 25 Jan 2010] |
|
|
|
Ken Kodama, Shin
Takagi & Akihiko Koga
Heredity.
101, 222-227 (2008) |
|
|
|
Akira Nukazuka,
Hajime Fujisawa, Toshifumi Inada, Yoichi Oda & Shin
Takagi
Genes & Development.
22, 1025-1036 (2008) |
| [以下、この論文の解説記事 |
 |
|
|
|
|
|
|
|
|
Fumi Nakao, Martin
L. Hudson, Motoshi Suzuki, Zachary Peckler, Rie Kurokawa,
Zhicen Liu, Keiko Gengyo-Ando, Akira Nukazuka, Takashi
Fujii, Fumikazu Suto,
Yukimasa Shibata, Go Shioi, Hajime Fujisawa, Shohei Mitani,
Andrew D. Chisholm &Shin Takagi
Genetics. 176, 1591-1607
(2007) |
|
|
|
 |
Zhicen Liu, Akira Nukazuka
& Shin Takagi
Development, Growth and Differentiation.
49, 49-59 (2007)
|
|
|
|
|
Zhicen Liu, Takashi
Fujii, Akira Nukazuka, Rie Kurokawa, Motoshi Suzuki, Hajime
Fujisawa & Shin Takagi
Developmental Biology. 282,
138-51 (2005) |
|
|
|
Claire Y. Be´nard,
Hania Ke´bir, Shin Takagi
& Siegfried Hekimi
Development.
131, 5947-58 (2004) |
|
|
|
Takashi Fujii,
Fumi Nakao, Yukimasa Shibata, Go Shioi, Eiji Kodama,
Hajime Fujisawa & Shin Takagi
Development. 129, 2053-2063 (2002) |
|
|
|
Asahiko Takahashi,
Hisako Muramatsu H, Shin Takagi,
Hajime Fujisawa, Yozo Miyake & Takashi Muramatsu
Journal of Biochemistry.
129(4), 599-606 (2001) |
|
|
|
Go Shioi,
Michinari Shoji, Masashi Nakamura, Takeshi Ishihara,
Isao Katsura, Hajime Fujisawa & Shin
Takagi
Genetics. 157, 1611-1622
(2001) |
|
|
|
Yukimasa Shibata,
Takashi Fujii, Joseph A. Dent, Hajime Fujisawa &
Shin Takagi
Genetics. 154, 635-646
(2000) |
|
|
原著論文(〜1999
年) |
Cellular
and axonal migrations are misguided along both body axes
in the maternal effect mau-2 mutants of Caenorhabditis
elegans.
Shin Takagi,
Claire Benard, Julia Pak, David Livingstone & Siegfried
Hekimi
Development,
124, 5115-5126 (1997) |
|
|
Identification
of a neuronal cell surface molecule, Plexin, in mice.
Toshiki Kameyama, Yasunori Murakami, Fumikazu Suto, Atsushi
Kawakami, Shin Takagi, Tatsumi
Hirata & Hajime Fujisawa
Biochemical
and Biophysical Research Communications, 226, 524-529.
(1996) |
|
|
Identification
of Plexin family molecules in mice.
Toshiki Kameyama, Yasunori Murakami, Fumikazu Suto, Atsushi
Kawakami, Shin Takagi, Tatsumi
Hirata & Hajime Fujisawa
Biochemical
and Biophysical Research Communications, 226, 396-402.
(1996) |
|
|
Growth-associated
expression of a membrane protein, neuropilin, in Xenopus
opticnerve fibers.
Hajime Fujisawa, Shin Takagi
& Tatsumi Hirata
Developmental
Neuroscience, 17, 343-349 (1995) |
|
|
Developmentally
regulated expression of a cell surface protein, neuropilin,
in the mouse nervous system.
Atsushi Kawakami, Takashi Kitsukawa, Shin
Takagi, & Hajime Fujisawa
Journal
of Neurobiology 29, 1-17 (1995) |
|
|
Plexin:
a novel neuronal cell surface molecule that mediates cell
adhesion via a homophilic binding mechanism in the presence
of calcium ion.
Kunimasa Ohta, Akihito Mizutani, Atushi Kawakami, Yasunori
Murakami, Yasuyo Kasuya, Shin Takagi,
Hideaki Tanaka & Hajime Fujisawa
Neuron
14, 1189-1199 (1995) |
|
|
Expression
of a cell adhesion molecule, neuropilin, in the developing
chick nervous system.
Shin
Takagi, Yasuyo Kasuya, Masayuki Shimizu, Takatoh
Matuura, Mari Tsuboi,
Atsushi Kawakami & Hajime Fujisawa
Developmental
Biology 170, 207-222 (1995) |
|
|
Differential
expression of two cell surface proteins, neuropilin and
plexin, in Xenopus olfactory axon subclasses.
Masahiko Satoda, Shin Takagi,
Kunimasa Ohta, Tatsumi Hirata & Hajime Fujisawa.
The Journal of Neuroscience
15(1), 942-955 (1995) |
|
|
The
membrane protein A5, a putative neuronal recognition molecule,
promotes neurite outgrowth.
Tatsumi Hirata, Shin Takagi
& Hajime Fujisawa
Neuroscience
Research 17, 159-169 (1993) |
|
|
Involvement
of neuronal cell surface molecule B2 in the formation
of retinal plexiform layers.
Kunimasa Ohta, Shin Takagi,
Hiroaki Asou & Hajime Fujisawa
Neuron
9, 151-161, (1992) |
|
|
The
A5-antigen, a candidate for the neuronal recognition molecule,
has homologies to complement components and coagulation
factors.
Shin Takagi,
Tatsumi Hirata, Kiyokazu Agata, Makoto Mochii, Goro Eguchi
& Hajime Fujisawa
Neuron
7, 295-307 (1991) |
|
|
A
diurnal variation of vasoactive intestinal peptide(VIP)
mRNA under a daily light-dark cycle in the rat suprachiasmatic
nucleus.
S. Okamoto, H. Okamura, M. Miyake, Y. Takahashi, S.
Takagi, Y. Akagi, K.Fukui, H. Okamoto & Y.
Ibata
Histochemistry 95,
525-528 (1991) |
|
|
An
aberrant retinal pathway and visual centers in Xenopus
tadpoles share a common cell surface molecule, A5 antigen.
Hajime Fujisawa, Tsukasa Ohtsuki, Shin
Takagi & Toshiaki Tsuji
Developmental
Biology 135, 231-240 (1989) |
|
|
Monoclonal
antibodies against species-specific antigens in the chick
central nervous system: Putative application as transplantation
markers in the chick-quail chimera.
Shin
Takagi, Toshiaki Tsuji, Masae Kinutani & Hajime
Fujisawa
Journal of Histochemistry
and Cytochemistry 37, 177-184 (1989) |
|
|
The
prosencephalon has the capacity to differentiate into
the optic tectum: Analysis by chick-specific monoclonal
antibodies in quail-chick chimeric brains.
Harukazu Nakamura, Shin Takagi,
Toshiaki Tsuji, Kohji A. Matsui & Hajime Fujisawa
Development, Growth and Differentiation
30, 717-725 (1989) |
|
|
Monoclonal
antibodies facilitate analysis of ocular development in
mice.
Toshiaki Tsuji, Shin Takagi
& Hajime Fujisawa
Experimental
Eye Research 47, 555-564 (1988) |
|
|
Specific
cell surface labels in the visual centers of Xenopus laevis
tadpole identified using monoclonal antibodies.
Shin Takagi, Toshiaki Tsuji,
Takashi Amagai, Tetsuro Takamatsu & Hajime Fujisawa
Developmental Biology 122,
90-100. (1987) |
|
|
Spatial
and temporal expression pattern of N-cadherin cell adhesion
molecules correlated with morphogenetic processes of chick
embryos.
Kohei Hatta, Shin Takagi,
Hajime Fujisawa & Masatoshi Takeichi
Developmental
Biology 20, 215-227. (1987) |
|
|
Plasticity
and rigidity of differentiation of brain vesicles studied
in quail-chick chimeras.
Harukazu Nakamura, Kensuke E. Nakano, Hiroharu H. Igawa,
Shin Takagi & Hajime
Fujisawa
Cell Differentiation
19, 187-193. (1986) |
|
|
Stimulated
crystallin synthesis in embryonic brain cells in culture.
Shin Takagi
Roux's
Archives of Developmental Biology 195, 15-21. (1986) |
|
|
Expression
of toxin receptors on cell surfaces in transdifferentiating
cultures of neural retina.
David I. DePomerai, Shin Takagi,
Hisato Kondoh & T.S. Okada
Development,
Growth and Differentiation 26, 111-119. (1984) |
|
|
Transdifferentiation
of putative neuronal cells of neural retina into lens:
A demonstration by chick-quail chimeric cultures.
Hisato Kondoh, Shin Takagi,
Kazuya Nomura & T.S.Okada
Roux's
Archives of Developmental Biology 192, 256-261.
(1983) |
|
|
Lentoidogenesis
from neural retina cells is effected by interactive relationships
between different cell types.
Shin
Takagi, Hisato Kondoh, Kazuya Nomura & T.S.Okada
Journal of Embryology and Experimental
Morphology 73, 97-109. (1983) |
|
|
Can
once neuronally differentiated cells of neural retina
be lentoidogenic in cell culture?
Kunio Yasuda, Shin Takagi,
Kazuya Nomura, Hisato Kondoh & T.S. Okada
Development,
Growth and Differentiation 24, 223-231. (1982) |
|
|
Expression
of neuronal specificities in "transdifferentiating"
cultures of neural retina.
Kazuya Nomura, Shin Takagi
& T. S. Okada
Differentiation
16, 114-127. (1980) |
|
|
Comparison
of neural and lens phenotype expression in the transdifferentiating
cultures of neural retina with different culture media.
Kiyokazu Agata, Hisato Kondoh, Shin
Takagi, Kazuya Nomura & T. S. Okada
Development,
Growth and Differentiation 22, 571-577. (1980) |
|
|
|
|
| Development and Neurobiology of C. elegans |
|
|
Research Overview |
As fertilized eggs develop into many-celled animals or plants, the shape of living tissues, organs and entire bodies undergo drastic changes. This complex process, called morphogenesis, has fascinated biologists for long times. Morphogensis is a coordinated process regulated by various signaling molecules. Semaphorins compose a major group of morphogenetic signaling molecules conserved in animals. Using a simple model animal C. elegans, we are trying to understand cellular and molecular mechanisms underlying the Semaphorin-mediated morphogenesis. Our studies have revealed that semaphorin signaling is tightly linked to mTOR signaling pathway. An unexpected finding is that the cellular morphogenesis
involves highly divergent cellular events such as mRNA translation and membrane dynamics.
We have also developed a novel method, IR-LEGO, exploiting heat-shock response for manipulating gene expression at the single-cell level in C. elegans. IR-LEGO will be a powerful tool for analyzing development and the nervous system. |
|
|
Projects |
1) Semaphorin signaling
Semaphorin signaling system in C. elegans |
The C. elegans genome contains 2 plexin (plx-1, -2) and 3 semaphorin genes (smp-1, -2, mab-20). The presence of the relatively small number of the genes makes C. elegans an attractive system for analyzing plexins and semaphorins in vivo. Taking a reverse genetic approach, we have generated plx-1and plx−2
mutations and determined the specific interactions between the semaphorin and plexin molecules (Fujii et al., 2002; Nakao et al., 2007). We have revealed that the semaphorin signaling systems in C. elegans are primarily involved in epidermal morphogenesis, such as formation of the ray, which is a sensory organ of
epidermal origin. We also showed that the SMP-1/PLX-1 signaling system regulates cell-contact-mediated stop signal for extension of epidermal cells during the early stages of vulval morphogenesis (Liu et al., 2005). |
Genetic analysis of semaphorin signaling pathway |
| In order to elucidate the signaling pathways downstream to plexin, we carried out a screen for suppressor mutations that revert the ray1 displacement defects of plx-1mutants. Identification of a mutation in the GCN1/gcn-1 gene, a known negative regulator of mRNA translation in yeast, as a suppressor led us to reveal that semaphorin signal regulates the epidermal morphogenesis by down regulating the phosphorylation of eIF2alpha, thereby stimulating mRNA translation (Nukazuka et al., 2008). We have also identified cofilin/ADF as a target of semaphorin-mediated mRNA translation via its 3’UTR. |
|
Recent identification of another suppressor as a mutation in the rictor gene (rict-1) encoding a TORC2 (TOR-Complex 2) component led us to reveal that semaphorin signaling promotes a shift from TORC2 to TORC1, which in turn changes cellular events downstream to mTOR drastically (Nukazuka et al., 2011). An essential link between semaphorin signaling and mTOR signaling, which plays pivotal roles in controlling diverse aspects of cellular metabolisms, suggests that TORCs are the central mediators in the semaphorin signal pathway, providing a hope for creating a unified view of this signaling pathway. |
|
| We will further exploit suppressor analysis to clarify underlying mechanisms with which semaphorin controls the dynamics of TORCs. This approach would also help to identify the upstream signals regulating TORC2, an unsolved issue in mTOR signaling. |
2) Technology development
IR-LEGO |
| We have been also interested in the development of research tools. The Infrared-laser-evoked gene operation (IR-LEGO) system, is designed to induce the heat shock response with high efficiency without causing cell damage, thereby effectively driving expression of a transgene under the control of a heat shock promoter. We have succeeded in applying IR-LEGO to living C. elegans (in collaboration with Shunsuke Yuba at AIST, Kamei et al., 2009). This method, enabling us to induce expression of desired genes in targeted cells, would serve as a useful tool for studying not only C. elegans but also many other multicellular organisms in vivo. |
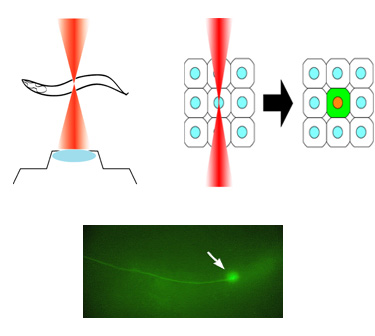 |
Induction of GFP in a targeted single neuron by using IR-LEGO |
|
|
Neurobiology is one of the research fields to which application of IR-LEGO would be particularly beneficial. For functional analysis of neural circuits, manipulation of targeted individual neurons would be extremely useful. We are now interested in combining the IR-LEGO technique with optogenetics.
Optogenetics, an emerging technology using light-driven ion channels or ion pumps for controlling excitable cells, have greatly facilitated the investigation of nervous systems in vivo. C. elegans, with its small transparent body and well-characterized neural circuits, is especially suited for optogenetic analyses.
Previous attempts to manipulate gene expression in single C. elegans neurons, however, seem to have a limited success because cell-specific promoters used in these studies usually drive gene expression in multiple types of neurons. We are currently trying to express optogenetic tools in targeted single neurons in C. elegans by using IR-LEGO. In addition to this, we are testing novel optogenetic tools, such as Arch, in C. elegans cells (Okazaki et al., 2012). |
|
| Study/Research opportunities |
|
|
|


