C. elegans
�O���[�v�Љ�@Development and Neurobiology of C. elegans
![]()

-�Z�}�t�H�����ƒ`�����|��̈ӊO�ȂȂ���
-IR-LEGO�F���[�U�𗘗p���Đ��̓��̒P�����E�ň�`�q��������
-���_�J�̃g�����X�|�]����C. elegans�œ]�ʂ�����
-����
�Z�}�t�H�����V�O�i���o�H�̌���
![]()
���B�̓Z�}�t�H�����Ƃ����`�������肪����ɂ��āA�����̌`���̂Ȃ��ɔ��肽���ƍl���Ă��܂��B�@�Z�}�t�H�����́A�ŏ��A�Ғœ����̔]���`�����ۂɐ_�o�זE����L�яo�������ۂ̍s��������߂镪�q�i�K�C�_���X���q�j�Ƃ��ē��肳��܂����B�@���̌�A���̕��q�̒��Ԃ��L�������E�ɑ��݂��đ傫�ȕ��q�t�@�~���[���`�����Ă���A���܂��܂ȑg�D�Ō`���̃V�O�i����`���邱�Ƃ��킩���Ă��܂����B�@�܂��A�Ғœ����̃K���̓]�ڗ}����Ɖu�n�̊������Ȃǂɂ��֗^���邱�Ƃ���A�ŋ߂ł͈�w�I�Ȗʂ����������������Ă��܂��B�@���B�̓Z�}�t�H�����̎�e�̂Ƃ��Ēm����j���[���s�����A�v���L�V���𐢊E�ōŏ��ɔ����E�N���[�j���O�����Ƃ����o�܂���A����܂ň�т��ăZ�}�t�H�����̌����𑱂��Ă��܂��B
�������̃O���[�v�͐���C. elegans���ޗ��ɗp���Ă��܂��BC. elegans�͓��Ɉ�`�w�E���q�����w�̌����ޗ��Ƃ��Ă�����Ă���A�X�s�[�f�B�[�Ȏ������\�ł��B������V���Ȃǐ����ɋ��ʂ����{�I���ۂ��������邽�߂ɁA���E���ŗp�����Ă��܂��B�@���ɃQ�m���v���W�F�N�g�A�זE���ARNAi�AGPF�̉��p�Ȃǂ̕����C.
elegans�̌������擱�I�������ʂ������Ƃ��]������A����܂łɂR�x�m�[�x���܂̑ΏۂƂȂ��Ă��܂��B�@�����w�����̃��f�������Ƃ��Ă͑咰�ۂ�y����L���ł����A�����̐����ɂ̓Z�}�t�H�����͑��݂��܂���B�@���B�́A�Z�}�t�H�����V�O�i���n�̊�{�I�Ȑ����������ǂ��������邽�߂ɂ́A�� ��C. elegans���ł��L���Ȏ����ޗ����ƍl���Ă��܂��B
��C. elegans���ł��L���Ȏ����ޗ����ƍl���Ă��܂��B
�Z�}�t�H�����ƒ`�����|��̈ӊO�ȂȂ���
�������̓Z�}�t�H������e�̂ł���v���L�V����`�q��C. elegans�ψّ̂��쐻���A�\��זE�̌`���ُ�ɂȂ邱�Ƃ������܂����B�@�����ŁA���̕\��ُ̈�Ƃ����\���^���肪����ɂ��ăZ�}�t�H�������זE���łǂ̂悤�ȃV�O�i����`���Ă���̂��A���̃V�O�i���`�B�o�H�ׂ邱�Ƃɂ��܂����B
�@�@�@�@�����A�Z�}�t�H�����V�O�i���Ɲh�R�I�ɓ�������Z�}�t�H�����V�O�i����}������o�H�E���q�����݂���A�����̗}�����o�H�E���q�̕ψقɂ���ăv���L�V����`�q�ψُّ̂̈킪���P�isuppress�j�����\��������܂��B�@�������́A���̂悤�ȕψفi�T�v���b�T�[�ψفj�̌������s���Ă��܂��B�@����܂łɃT�v���b�T�[�ψق̌����ƂȂ��`�q��˂��~�߂邱�ƂŁA�Z�}�t�H�����V�O�i����mRNA�|��Ɋւ��Ƃ������Ƃ��킩���Ă��܂����B�@�זE�`�Ԓ��߂�mRNA�|��Ƃ�������܂Ŗ��W�Ǝv���Ă������ۂɂȂ��肪���邱�Ƃ��킩��A���B����ϋ����܂����iNukazuka et al., 2008�j�B
�ʔ������ƂɁA�ŋ߁A�Ғœ����ł��Z�}�t�H�����Ȃǂ̃K�C�_���X���q��mRNA�|�����Đ_�o������[�����~���̋����ɉe�����y�ڂ����Ƃ�����Ă��܂��B�@���낢��ȍזE�̌`�ԕω��ɂ����āAmRNA�|��͏d�v�Ȗ������ʂ����Ă���̂�������܂���B
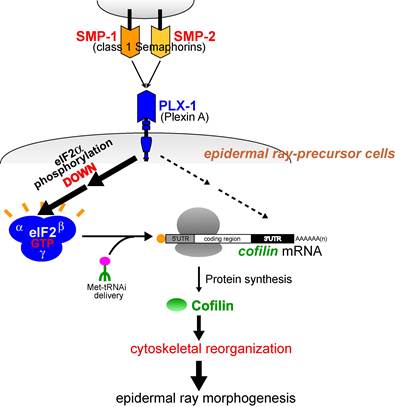
�}�F����C. elegan Semaphorin �V�O�i���͕\��זE�̌`�ԁE�z�u�߂��APlexin��`�q(plx-1)�̌����͊��o��ray1�̈ʒu�ُ�������N�������Ƃ��m���Ă���B�@����ray1�\���^�̗}���ψٌ����������ɂ��āASemaphorin / Plexin�ψّ̂ł͖|��J�n���qeIF2a�̃����_�����㏸���A�t���Z�}�t�H�����V�O�i����������eIF2a�����_����ቺ�����`���������i���邱�Ƃ��A���̓��ŏؖ����ꂽ�B�@����ɁASemaphorin /
Plexin�ψّ̂ł�Ray 1�ʒu�ُ�̌��ƂȂ�\��זE�̌`�Ԉُ�͒`���������ቺ�ɋN�����邱�Ƃ����炩�ɂȂ����B�@�܂��A�Z�}�t�H�����͍זE���i�n�̒��߈��q�R�t�B�����̍�����I��I�ɑ��i���A���̑I�𐫂ɂ̓R�t�B����mRNA����3�fUTR���d�v�ł��邱�Ƃ����炩�ɂȂ����B�@�����̌��ʂ́A�Z�}�t�H�����V�O�i���ɂ��זE���i�n���߈��q���Ǐ��I�ɍ�������A���̌��ʁA�זE���i�̉��ς����i����čזE�`�Ԃ��ω�����Ƃ����A�V�K�ȍזE�`�Ԓ��ߋ@�\���������Ă���B
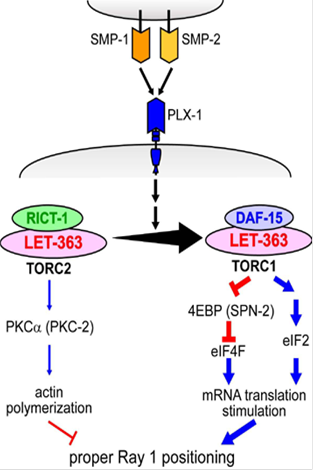
����ɁA�ʂ̃T�v���b�T�[�ψ�rict-1�̌�������A�|����͂��߂Ƃ���l�X�ȍזE��ӂ̌�������Ƃ�����mTOR�o�H�ƃZ�}�t�H�����V�O�i�������ڂɊW���Ă��邱�Ƃ��킩��܂����B�@�����_���y�f�ł���mTOR�́ATORC1��TORC2�Ƃ����@�\�̈قȂ�2��ނ̕����̂��`�����܂��B�@�������̓Z�}�t�H�����V�O�i���ɂ�TORC1��������Ɠ�����TORC2�����������铭�������邱�Ƃ����܂����B�@TORC1�ʂ̑�����mRNA�|��̊������������N�����A����ATORC2�ʂ̌����ɂ��PKCa�������}������A�N�`���זE���i���ω����܂��iNukazuka et al., 2011�j�B�@�@�Z�}�t�H�����V�O�i����mTOR�o�H����čזE�`�ԕω��������N�������Ƃ��킩�������ƂŁA�Z�}�t�H�����V�O�i���������N�������l�ȍזE�����̕ω���I�ɑ�����ڏ������Ă��܂����B�@�Ȃ��AmTOR�o�H�͌��ݑ�σA�N�e�B�u�Ɍ������i�߂��Ă���o�H�ŁA���̌o�H�̉𖾂ɂ��v���L�V����`�q�ψّ̃T�v���b�T�[�ψٌ������𗧂Ɗ��҂��Ă��܂��B
�}�F�@�Z�}�t�H�����V�O�i���͍זE����TORC1������TORC2�̌����������N�����B�@����ɔ����ATORC1������eIF2a�̃����_�����x���㏸�ɂ��eIF2�n�̊������ƁA�����炭4EBP�̃����_�������eIF4F�̊������Ƃɂ��AmRNA�|��̊������������N�������B�܂��ATORC2�̉����ł�PKCa�̃����_�����x�����������邱�Ƃɂ��A�N�`���d�����}�������ƍl������B
�ŋ߁A����ɕʂ̃T�v���b�T�[�ψق̌�������A�Z�}�t�H�����V�O�i���ɂ��זE�`�Ԑ���ɂ�endocytosis.
�����Ԃ̐��䂪�֗^���邱�Ƃ��킩���Ă��܂����B�@�܂��ڍׂ͕s���ł����Aendocytosis�͐ڒ����q�̂悤�Ȗ��`�����̓��Ԃ�זE���̖ʐς߂��邱�ƂōזE�`�ԕω��Ɋւ���Ă���̂�������܂���B�@���āA�זE�`�Ԓ��߂Ƃ����ƍזE���i�̍č\�������ɕ����т܂������ꂾ���łȂ�mRNA�|��▌���ԂƂ������ӊO�ȃC�x���g���d�v�Ȗ������ʂ����Ă��邱�Ƃ��A�@�������̌������畂���яオ���Ă��܂����B�@�����炭�זE�`�ԕω��ɂ͍זE�̂���߂đ��ʓI�ȓ����̕ω����K�v�ł���A��L�ȊO�̍זE�@�\���֗^����̂ł��傤�B�@�������́A�Z�}�t�H�����V�O�i���̌���������ɐi�߂邱�ƂŁA���̂悤�Ȑ��̓��ł̍זE�`�ԕω��̎��Ԃ𖾂炩�ɂ������Ɗ���Ă��܂��B
![]()
�V�����Z�p�̊J��
![]()
IR-LEGO�F���[�U�𗘗p���Đ��̓��̒P��זE�ň�`�q��������
�`���]���̒��ł̈�`�q��������͐����Ȋw�����Ō������Ȃ��Z�p�ɂȂ��Ă��܂��B�@�������A�ʏ�̈�`�q�g�D���ٓI�v�����[�^�[�ł́A�K�����������҂̖ړI�̍זE�ɖړI�̎����Ɉ�`�q�������邱�Ƃ͂ł��܂���B�@�\��זE�̌�����i�߂�ߒ��ŁA���������A�g�ǂ�����ċψ�ȍזE�W�c���̈ꕔ�̑_�����זE�����ŖړI�̈�`�q��������悢�̂��h�Ƃ������ɔY�܂���܂����B�@�����āA�ԊO���[�U�𗘗p������`�q��������p������(IR-LEGO: InfraRed Laser Evoked-Gene
Operator)���J�����������|��@�r��@���m�i�Y�����j�Ƌ����������s���AC.
elegans�̒P��W�I�זE�ł̈�`�q�����n�𗧂��グ�܂��� (Kamei et al., 2009)�B
�قƂ�ǑS�Ă̐����́A�M�X�g���X�ɑ��ĔM�V���b�N�`���������čזE��M��Q������܂��B�@�����ŁA�M�V���b�N�`�����̃v�����[�^�[����͂�������`�q�w���q�����g�����X�W�[���i�`���]���̒��̊O����`�q�j������Ă����A�זE�����M���邱�ƂŖړI�̈�`�q�w�������邱�Ƃ��ł��܂��B�@���̂悤�ȁA�g�����X�W�[�������̂��g���Č��������ő_�����זE�Ƀ��[�U�Ǝ˂����āA���̍זE�ł�����`�q������U������Ƃ����̂�IR-LEGO�̌����ł��B
IR-LEGO�́A�g���ł��A�ǂ��ł��ȒP�Ɉ�`�q������U������h���Ƃ��\�Ƃ���f���炵���Z�p�ł��B�@����AC. elegans�ȊO�̂��܂��܂Ȑ�����ւ̉��p�����҂���܂��B


�}�F�@IR-LEGO�������i���j��GFP�������������̐_�o�זE(�E)

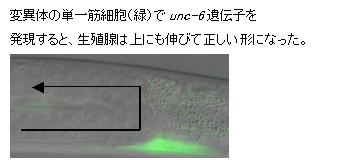
�}�FIR-LEGO��p�������̓��זE����̗�B�@C. elegans�c���̉��ʒ[�זE�iDTC�j�ƌĂ��זE�͑̂̒����ړ����Ȃ��琶�B�튯�����グ��BDTC�̈ړ������͕ʂ̍זE�Ŕ�������זE�U���Ɋւ���`�q�iunc-6�j�ɂ���Đ��䂳��Ă���Aunc-6�����������̕ψّ̂ł�DTC�̈ړ������������Ȃ�A����Ȑ��B�튯���`������Ȃ��B�@�����ŁA�ψّ̂̒��ŁA�{��unc-6������͂��̍זE�ɐԊO�����Ǝ˂���unc-6��������ƁADTC�͍����m���Ő����������Ɉړ��ł���悤�ɂȂ萳��Ȑ��B�튯���`�������B�@IR-LEGO��������p���邱�Ƃ�unc-6�ɂ��DTC�̗U���@�\�����ڍׂɒ��ׂ邱�Ƃ��ł���B
�_�o��H��͂�IR-LEGO�̉��p���ł����҂���镪��̂ЂƂł��B�@�̂̒��ő_�����P��_�o�זE�̊��������݂ɒ��߂ł���A��H���\������X�̐_�o�זE�̉�H���ł̖����𖾂ɑ傢�ɖ𗧂ł��傤�B�@���B�͌���IR-LEGO��Optogenetics �Ƒg�ݍ��킹�邱�Ƃɓ��ɋ����������Ă��܂��BOptogenetics�i����`�w�j�Ƃ͌Íۂ⌴�������������쓮���̃`���l���E�|���v�𗘗p���āA�_�o�זE�Ȃǂ̋������זE�̊��������ɂ���đ��삷��Z�p�ŁA�ߔN�A�}�������Ă��܂��B�@����܂ł�Optogenetics�����ł́A��`�q�����̂��߂ɐ_�o�זE�̃T�u�^�C�v���ٓI�ȃv�����[�^�[�����p����Ă��܂����B�@�������A�����̂قƂ�ǂ̃v�����[�^�[�͕����̍זE�ň�`�q�������Ă��܂����߁A�_�����P��זE�ł̈�`�q�����ɂ͗��p�ł��܂���B�@IR-LEGO�͂��̖�����������̂ɑł��ĕt���̋Z�p�ł���A���݁AC. elegans�̑S�Ă̐_�o�זE��W�I�Ƃ��ĒP��זE�ň��肵�Ĉ�`�q�����������N�������Ƃ̂ł���������������ł��B
�܂��AOptogenetics�̏����ɂ͐F���ŊJ���J�`�I���`���l���ł���`���l�����h�v�V���iChop2�j��ԐF���Ŋ�������Cl-�C�I�����זE���ɑg�ݓ����|���v�ł���n�����h�v�V���iNpHR�j���g���Ă��܂������A�ߔN�A�Ғœ����ł͕ψٌ^Chop2��Arch��Mac�Ƃ������V�����^���p�N�������p�����悤�ɂȂ��Ă��܂����B�@���B���b�Delegans�̐_�o�זE�̊�����Arch�ɂ���Č����悭�}���ł��邱�Ƃ������܂����B
���_�J�̃g�����X�|�]����C. elegans�œ]�ʂ�����
�܂��A�������͌��݁A���_�J�̃g�����X�|�]��Tol1��C. elegans�œ]�ʂ���������n���J�����ł�
�i�É�@�͕F�@���m�F�@���s��w�@�Ƃ̋������� Kodama et al., 2008�j�j�B�@C. elegans�Ō��݁A��ʓI�ɗp�����Ă���`���]���@�ł͒P��R�s�[�̊O����`�q�������ǂ��ȒP�ɐ��F�̂ɑg�ݍ��ނ��Ƃ�����A���܂��܂Ȏ����̏�ǂƂȂ��Ă��܂��B�@Tol1�������悭���B�זE�œ]�ʂ����邱�Ƃ��ł���A�`���]�����e�ՂɂȂ邾���łȂ��AC. elegans�ł���܂łł��Ȃ������G���n���T�[�g���b�v��W�[���g���b�v�Ƃ������������\�ɂȂ�܂��B
�V�����Z�p�͉Ȋw�����̐i���������炷�����͂̈�ł��B�@�������́A���̂悤�ȋZ�p�J����ʂ���C.
elegans��p���������̉\��������ɍL���Đ��������ƍl���Ă��܂��B
���B�̌����������Əڂ����m�肽���Ǝv�������A���B�ƈꏏ�Ɍ������Ă݂����Ǝv�������́A�ǂ����C�y�ɘA�����Ă��������B
![�l�p�`: �p���ۂ�����: ���@�V�@�i�������@����j
������w���w���������w�@������������O���[�v�@�y����
�����s����s�V��
���w���n��E��2�KE207����
��464-8602
FAX:�@81-52-789-2537 (dial-in)
TEL:�@81-52-789-5039 (dial-in)
e-mail: i45116a[at]nucc.cc.nagoya-u.ac.jp](170313%20HP.files/image023.png)
![]() ���� / publications
���� / publications
�����_��(2000�`)
Motoshi Suzuki, Naoya
Toyoda N & Shin Takagi
PLoS ONE (2014) 9(1): e85783.
doi:10.1371/journal.pone.0085783
Optical
silencing of C. elegans cells with
Arch proton pump
Ayako Okazaki, Yuki Sudo, Shin Takagi
PLoS ONE (2012) 7(5):e35370.
doi: 10.1371/journal.pone.0035370.
A shift
of the TOR Adaptor from Rictor towards Raptor by Semaphorin in C. elegans
Akira Nukazuka, Shusaku Tamaki, Kunihiro
Matsumoto, Yoichi Oda, Hajime Fujisawa, & Shin
Takagi
Nature Communications 2:484 doi: 10.1038/ncomms1495 (2011).
[�ȉ��A���̘_���̉���L��:
�����iC.elegans�j�ɂ����āA�Z�}�t�H�����ɂ����TOR�̌��������Rictor����Raptor������ւ��
Semaphorins
contribute to cellular changes by regulating two TOR complexes]
Infrared
laser-mediated gene induction in targeted single cells in vivo.
Yasuhiro
Kamei, Motoshi Suzuki, Ken Watanabe, Kazuhiro Fujimori, Takashi Kawasaki,
Tomonori Deguchi, Yoshihiro Yoneda, Takeshi Todo, Shin Takagi, Takashi
Funatsu, & Shunsuke Yuba
Nature Methods. 6(1), 79-81 (2009).
[selected paper: Faculty of 1000, 25 Jan 2010]
Ken Kodama, Shin
Takagi & Akihiko Koga
Heredity. 101, 222-227 (2008)
Semaphorin controls
epidermal morphogenesis by stimulating mRNA translation via eIF2a in C.
elegans.
Akira
Nukazuka, Hajime Fujisawa, Toshifumi Inada, Yoichi Oda & Shin Takagi
Genes
& Development. 22, 1025-1036 (2008)
 [�ȉ��A���̘_���̉���L���B�@
[�ȉ��A���̘_���̉���L���B�@
Semaphorin signaling in morphogenesis: found in translation.�@Chisholm A.D.�@Genes Dev. 2008 Apr 15;22(8):955-9
Thinking Globally, Acting Locally. Annalisa M. VanHook
(22 April 2008) Sci. Signal.
1
(16), ec146.
Research highlights�@ Nature
Structural & Molecular
Biology
15, 434 (2008)
Functional diversity
and mechanisms of action of the semaphorins. Eickholot B.J. Development
135(16):2689-94]
Fumi
Nakao, Martin L. Hudson, Motoshi Suzuki, Zachary Peckler, Rie Kurokawa, Zhicen
Liu, Keiko Gengyo-Ando, Akira Nukazuka, Takashi Fujii, Fumikazu Suto, Yukimasa
Shibata, Go Shioi, Hajime Fujisawa, Shohei Mitani, Andrew D. Chisholm &
Shin
Takagi
Genetics. 176,
1591-1607 (2007)
Zhicen Liu, Akira Nukazuka
& Shin Takagi
Development, Growth and Differentiation. 49, 49-59
(2007)�@�@

C.
elegans PlexinA PLX-1 mediates a cell contact-dependent stop signal in vulval
precursor cells.
Zhicen
Liu, Takashi Fujii, Akira Nukazuka, Rie Kurokawa, Motoshi Suzuki, Hajime
Fujisawa & Shin Takagi
Developmental Biology. 282, 138-51 (2005)
mau-2 acts cell-autonomously to guide axonal migrations in Caenorhabditis
elegans.
Claire
Y. Bénard, Hania Kébir, Shin Takagi & Siegfried Hekimi
Development. 131,
5947-58 (2004)
Takashi
Fujii, Fumi Nakao, Yukimasa Shibata, Go Shioi, Eiji
Kodama, Hajime Fujisawa & Shin Takagi
Development. 129, 2053-2063 (2002)
A splicing factor,
Prp8: preferential localization in the testis and ovary in adult mice.
Asahiko Takahashi, Hisako Muramatsu H, Shin
Takagi, Hajime Fujisawa, Yozo Miyake & Takashi Muramatsu
Journal of Biochemistry. 129(4), 599-606
(2001)
Mutations
affecting nerve attachment of Caenorhabditis elegans.
Go
Shioi, Michinari Shoji, Masashi Nakamura, Takeshi Ishihara, Isao Katsura,
Hajime Fujisawa & Shin Takagi
Genetics. 157, 1611-1622 (2001)
Yukimasa Shibata, Takashi Fujii, Joseph
A. Dent, Hajime Fujisawa & Shin Takagi
Genetics. 154, 635-646 (2000)
�����_���i�`1999�N�j
Cellular
and axonal migrations are misguided along both body axes in the maternal effect
mau-2 mutants of Caenorhabditis elegans.
Shin
Takagi,
Claire Benard, Julia Pak, David Livingstone & Siegfried Hekimi
Development, 124, 5115-5126
(1997)
Identification
of a neuronal cell surface molecule, Plexin, in mice.
Toshiki
Kameyama, Yasunori Murakami, Fumikazu Suto, Atsushi Kawakami,
Shin Takagi, Tatsumi Hirata & Hajime Fujisawa
Biochemical
and Biophysical Research Communications, 226, 524-529. (1996)
Identification
of Plexin family molecules in mice.
Toshiki
Kameyama, Yasunori Murakami, Fumikazu Suto, Atsushi Kawakami, Shin Takagi,
Tatsumi Hirata & Hajime Fujisawa
Biochemical
and Biophysical Research Communications, 226, 396-402. (1996)
Growth-associated
expression of a membrane protein, neuropilin, in Xenopus optic nerve fibers.
Hajime
Fujisawa, Shin Takagi & Tatsumi Hirata
Developmental
Neuroscience,
17, 343-349 (1995)
Developmentally
regulated expression of a cell surface protein, neuropilin, in the mouse
nervous system.
Atsushi
Kawakami, Takashi Kitsukawa, Shin Takagi, & Hajime Fujisawa
Journal
of Neurobiology
29, 1-17 (1995)
Plexin:
a novel neuronal cell surface molecule that mediates cell adhesion via a
homophilic binding mechanism in the presence of calcium ion.
Kunimasa
Ohta, Akihito Mizutani, Atushi Kawakami, Yasunori Murakami, Yasuyo Kasuya, Shin
Takagi, Hideaki Tanaka & Hajime Fujisawa
Neuron 14, 1189-1199 (1995)
Expression
of a cell adhesion molecule, neuropilin, in the developing chick nervous
system.
Shin
Takagi,
Yasuyo Kasuya, Masayuki Shimizu, Takatoh Matuura, Mari Tsuboi, Atsushi Kawakami
& Hajime Fujisawa
Developmental
Biology 170,
207-222 (1995)
Differential
expression of two cell surface proteins, neuropilin and plexin, in Xenopus
olfactory axon subclasses.
Masahiko
Satoda, Shin Takagi, Kunimasa Ohta, Tatsumi Hirata & Hajime
Fujisawa.
The
Journal of Neuroscience
15(1), 942-955 (1995)
The
membrane protein A5, a putative neuronal recognition molecule, promotes neurite
outgrowth.
Tatsumi
Hirata, Shin Takagi & Hajime Fujisawa
Neuroscience
Research 17,
159-169 (1993)
Involvement
of neuronal cell surface molecule B2 in the formation of retinal plexiform
layers.
Kunimasa
Ohta, Shin Takagi, Hiroaki Asou & Hajime Fujisawa
Neuron 9, 151-161, (1992)
The
A5-antigen, a candidate for the neuronal recognition molecule, has homologies
to complement components and coagulation factors.
Shin
Takagi,
Tatsumi Hirata, Kiyokazu Agata, Makoto Mochii, Goro Eguchi & Hajime
Fujisawa
Neuron 7, 295-307 (1991)
A
diurnal variation of vasoactive intestinal peptide(VIP) mRNA under a daily
light-dark cycle in the rat suprachiasmatic nucleus.
S.
Okamoto, H. Okamura, M. Miyake, Y. Takahashi, S. Takagi, Y. Akagi,
K.Fukui, H. Okamoto & Y. Ibata
Histochemistry 95, 525-528 (1991)
An
aberrant retinal pathway and visual centers in Xenopus tadpoles share a common
cell surface molecule, A5 antigen.
Hajime
Fujisawa, Tsukasa Ohtsuki, Shin Takagi & Toshiaki Tsuji
Developmental
Biology 135,
231-240 (1989)
Monoclonal
antibodies against species-specific antigens in the chick central nervous
system: Putative application as transplantation markers in the chick-quail
chimera.
Shin
Takagi,
Toshiaki Tsuji, Masae Kinutani & Hajime Fujisawa
Journal
of Histochemistry and Cytochemistry 37, 177-184 (1989)
The
prosencephalon has the capacity to differentiate into the optic tectum:
Analysis by chick-specific monoclonal antibodies in quail-chick chimeric
brains.
Harukazu
Nakamura, Shin Takagi, Toshiaki Tsuji, Kohji A. Matsui & Hajime
Fujisawa
Development,
Growth and Differentiation
30, 717-725 (1989)
Monoclonal
antibodies facilitate analysis of ocular development in mice.
Toshiaki
Tsuji, Shin Takagi & Hajime Fujisawa
Experimental
Eye Research
47, 555-564 (1988)
Specific
cell surface labels in the visual centers of Xenopus laevis tadpole identified
using monoclonal antibodies.
Shin
Takagi, Toshiaki
Tsuji, Takashi Amagai, Tetsuro Takamatsu & Hajime Fujisawa
Developmental
Biology 122,
90-100. (1987)
Spatial
and temporal expression pattern of N-cadherin cell adhesion molecules
correlated
with morphogenetic processes of chick embryos.
Kohei
Hatta, Shin Takagi, Hajime Fujisawa & Masatoshi Takeichi
Developmental
Biology 20,
215-227. (1987)
Plasticity
and rigidity of differentiation of brain vesicles studied in
quail-chick
chimeras.
Harukazu
Nakamura, Kensuke E. Nakano, Hiroharu H. Igawa, Shin Takagi & Hajime
Fujisawa
Cell
Differentiation
19, 187-193. (1986)
Stimulated
crystallin synthesis in embryonic brain cells in culture.
Shin
Takagi
Roux's
Archives of Developmental Biology 195, 15-21. (1986)
Expression
of toxin receptors on cell surfaces in transdifferentiating
cultures
of neural retina.
David
I. DePomerai, Shin Takagi, Hisato Kondoh & T.S. Okada
Development,
Growth and Differentiation
26, 111-119. (1984)
Transdifferentiation
of putative neuronal cells of neural retina into lens: A demonstration by
chick-quail chimeric cultures.
Hisato
Kondoh, Shin Takagi, Kazuya Nomura & T.S.Okada
Roux's
Archives of Developmental Biology 192, 256-261. (1983)
Lentoidogenesis
from neural retina cells is effected by interactive relationships between different
cell types.
Shin
Takagi,
Hisato Kondoh, Kazuya Nomura & T.S.Okada
Journal
of Embryology and Experimental Morphology 73, 97-109. (1983)
Can
once neuronally differentiated cells of neural retina be lentoidogenic in cell
culture?
Kunio
Yasuda, Shin Takagi, Kazuya Nomura, Hisato Kondoh & T.S. Okada
Development,
Growth and Differentiation
24, 223-231. (1982)
Expression
of neuronal specificities in "transdifferentiating" cultures of
neural retina.
Kazuya
Nomura, Shin Takagi & T. S. Okada
Differentiation
16, 114-127. (1980)
Comparison
of neural and lens phenotype expression in the transdifferentiating cultures of
neural retina with different culture media.
Kiyokazu
Agata, Hisato Kondoh, Shin Takagi, Kazuya Nomura & T. S. Okada
Development,
Growth and Differentiation
22, 571-577. (1980)
![]()
Development and Neurobiology of C.
elegans
Research Overview
As fertilized eggs develop
into many-celled animals or plants, the shape of living tissues, organs and entire
bodies undergo drastic changes. This complex process, called morphogenesis, has
fascinated biologists for long times. Morphogensis is a coordinated process
regulated by various signaling molecules. Semaphorins compose a major group of
morphogenetic signaling molecules conserved in animals. Using a simple model
animal C. elegans, we are trying to understand cellular and
molecular mechanisms underlying the Semaphorin-mediated morphogenesis. Our studies have revealed that
semaphorin signaling is tightly linked to mTOR signaling pathway. An unexpected
finding is that the cellular morphogenesis involves highly divergent cellular
events such as mRNA translation and membrane dynamics.
We
have also developed a novel method, IR-LEGO,
exploiting heat-shock response for manipulating gene expression at the single-cell
level in C. elegans. IR-LEGO will be
a powerful tool for analyzing development and the nervous system.
Projects
1) Semaphorin
signaling
Semaphorin
signaling system in C. elegans
The C. elegans genome contains 2 plexin (plx-1,
-2) and 3 semaphorin genes (smp-1, -2, mab-20). The presence of the
relatively small number of the genes makes C. elegans an attractive
system for analyzing plexins and semaphorins in vivo. Taking a reverse
genetic approach, we have generated plx-1and plx–2 mutations and
determined the specific interactions between the semaphorin and plexin
molecules (Fujii et
al., 2002; Nakao
et al., 2007). We have revealed that the semaphorin signaling systems in C.
elegans are primarily involved in epidermal morphogenesis, such as
formation of the ray, which is a sensory organ of epidermal origin. We also
showed that the SMP-1/PLX-1 signaling system regulates cell-contact-mediated
stop signal for extension of epidermal cells during the early stages of vulval
morphogenesis (Liu
et al., 2005).
Genetic
analysis of semaphorin signaling pathway
In order to elucidate the signaling pathways
downstream to plexin, we carried out a screen for suppressor mutations that
revert the ray1 displacement defects of plx-1mutants.
Identification of a mutation in the GCN1/gcn-1 gene, a known negative regulator
of mRNA translation in yeast, as a suppressor led us to reveal that semaphorin
signal regulates the epidermal morphogenesis by down regulating the
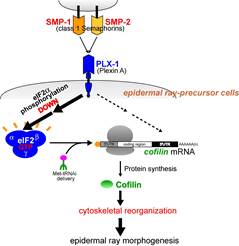
phosphorylation of eIF2alpha, thereby stimulating mRNA translation (Nukazuka et al., 2008).
We have also identified cofilin/ADF as a target of semaphorin-mediated mRNA
translation via its 3�fUTR.
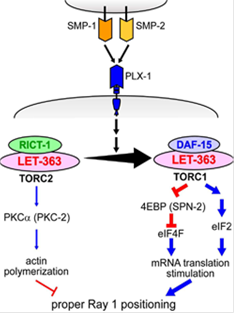
Recent identification of another suppressor as a
mutation in the rictor gene (rict-1)
encoding a TORC2 (TOR-Complex 2) component led us to reveal that semaphorin
signaling promotes a shift from TORC2 to TORC1, which in turn changes cellular
events downstream to mTOR drastically (Nukazuka
et al., 2011). An essential link between semaphorin signaling and mTOR
signaling, which plays pivotal roles in controlling diverse aspects of cellular
metabolisms, suggests that TORCs are the central mediators in the semaphorin
signal pathway, providing a hope for creating a unified view of this signaling
pathway.
We will further
exploit suppressor analysis to clarify underlying mechanisms with which
semaphorin controls the dynamics of TORCs. This approach would also help to identify
the upstream signals regulating TORC2, an unsolved issue in mTOR signaling.
2) Technology development
IR-LEGO
We have been also interested in the development
of research tools. The Infrared-laser-evoked
gene operation (IR-LEGO) system, is designed to induce the heat
shock response with high efficiency without causing cell damage, thereby
effectively driving expression of a transgene under the control of a heat shock
promoter. We have succeeded in applying
IR-LEGO to living C. elegans (in collaboration with Shunsuke Yuba at
AIST, Kamei
et al., 2009; Suzuki
et al 2014). This method, enabling us to induce expression of desired genes
in targeted cells, would serve as a useful tool for studying not only C.
elegans but also many other multicellular organisms in vivo.
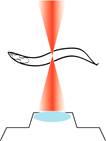
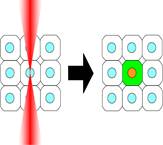
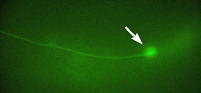
Induction of GFP in a targeted single neuron by
using IR-LEGO
Neurobiology is one
of the research fields to which application of IR-LEGO would be particularly
beneficial. For functional analysis of neural circuits, manipulation of
targeted individual neurons would be extremely useful. We are now interested in
combining the IR-LEGO technique with optogenetics. Optogenetics, an emerging
technology using light-driven ion channels or ion pumps for controlling
excitable cells, have greatly facilitated the investigation of nervous systems in vivo. C. elegans, with its small transparent body and well-characterized
neural circuits, is especially suited for optogenetic analyses. Previous attempts to manipulate gene expression in single C.
elegans neurons, however, seem to have a limited success because
cell-specific promoters used in these studies usually drive gene expression in
multiple types of neurons. We are currently trying to express optogenetic tools in targeted
single neurons in C. elegans by
using IR-LEGO. In addition to this, we are testing novel optogenetic tools,
such as Arch, in C. elegans cells
(Okazaki et al., 2012).
Study/Research opportunities
![�l�p�`: �p���ۂ�����: Contact
Shin Takagi D.Sci.
Development and Growth Regulation
Division of Biological Science,
Graduate School of Science,
Nagoya University,
Furo-cho, Chikusa-ku,
Nagoya 464-8602,
JAPAN
e-mail: i45116a[at]nucc.cc.nagoya-u.ac.jp
TEL: 81-52-789-2537
FAX: 81-52-789-5039](170313%20HP.files/image036.png)
Please also visit: Nagoya University
Global 30 International Program
Biological
and Bioagricultural Sciences Graduate Program